La FDA approuve la pompe cardiaque Impella ECP et les premiers patients sont recrutés dans un essai clinique pivot
La FDA approuve la pompe cardiaque Impella ECP et les premiers patients sont recrutés dans un essai clinique pivot
DANVERS, Massachusetts--(BUSINESS WIRE)--Abiomed (Nasdaq : ABMD) annonce que la Food and Drug Administration (FDA) américaine a approuvé la version de l'Impella ECP qui sera utilisée dans l'essai pivot du dispositif Impella ECP, ainsi que le recrutement des deux premiers patients dans cet essai. Amir Kaki, MD, directeur de l'assistance circulatoire mécanique à l'Ascension St. John Hospital de Détroit, a mené les procédures. Cet essai multicentrique, prospectif et mono-groupe évaluera le taux d'événements cardiovasculaires et vasculaires cérébraux indésirables majeurs chez les patients adultes qui reçoivent une assistance Impella ECP au cours d'une intervention coronarienne percutanée (ICP) élective ou urgente à haut risque.
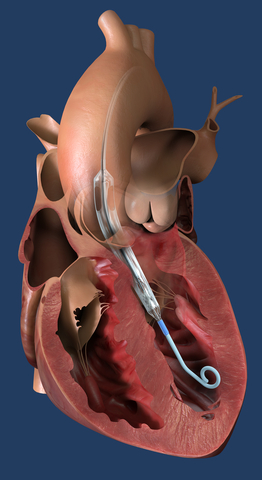
L'Impella ECP est la plus petite pompe cardiaque au monde et la seule compatible avec les techniques d'accès et de fermeture des petits orifices. Elle présente un diamètre de 9 Fr lors de son insertion et de son retrait du corps. Une fois insérée dans le corps, elle se dilate et prend en charge la fonction de pompage du cœur, en fournissant des débits de pointe jusqu'à 5 L/min.
Les deux patients recrutés dans l'essai ont reçu une assistance Impella ECP au cours de poses difficiles d'endoprothèses coronaires principales gauches impliquant des lésions de bifurcation fortement calcifiées. Après le retrait de l'Impella ECP, le dispositif du premier patient a été fermé avec une fermeture de 8 Fr.
« L'équipe de chercheurs et l'équipe clinique de l'Ascension St. John sont très heureuses d'avoir recruté les premiers patients de l'essai pivot approuvé par la FDA sur l'Impella ECP », a déclaré le Dr Kaki, chercheur principal national de l'étude. « L'Impella ECP offre aux médecins la possibilité de fournir un soutien hémodynamique essentiel lors d'ICP à haut risque en fournissant un débit similaire ou supérieur à celui offert par d'autres options à l'aide d'une plus petite gaine d'accès vasculaire. Cette technologie a le potentiel d'améliorer la sécurité des patients et le débit du laboratoire de cathétérisme en raison d'une plus petite artériotomie nécessaire à la pose de la pompe ».
« L'Impella ECP témoigne du leadership d'Abiomed en matière de technologie et d'innovation, puisque nous avons franchi l'écueil des petits orifices en développant la plus petite pompe cardiaque au monde », a déclaré Mike Minogue, président du conseil, président et CEO d'Abiomed. « Chez Abiomed, nous restons déterminés à développer des technologies plus petites, plus intelligentes et plus connectées qui amélioreront les résultats des patients atteints de maladies cardiaques. Je félicite les équipes de la communauté médicale et d'Abiomed qui nous ont permis d'y arriver ».
En juin 2020, la FDA a approuvé l'étude de faisabilité précoce (EFS) de l'Impella ECP. Cinquante-quatre patients ont été traités à ce jour dans l'EFS, notamment certains patients traités selon le protocole de l'essai clinique pivot. L'Impella ECP a obtenu de la FDA la désignation de dispositif révolutionnaire en août 2021. Cette désignation témoigne du fait que l'Impella ECP répond aux exigences strictes de la FDA en tant que dispositif révolutionnaire. L'essai clinique pivot de l'Impella ECP a reçu l'approbation de la FDA le 2 mars 2022 et recrutera jusqu'à 217 patients aux États-Unis. Des informations supplémentaires sur l'essai pivot sont disponibles ici.
L'Impella ECP est un dispositif expérimental limité par la loi fédérale à un usage expérimental uniquement.
À PROPOS D'ABIOMED
Basée à Danvers, dans le Massachusetts, aux États-Unis, Abiomed (Nasdaq : ABMD) est un fournisseur de premier plan de technologies médicales d'assistance circulatoire et d'oxygénation. Nos produits sont conçus pour permettre au cœur de se reposer et de récupérer en améliorant le flux sanguin et/ou pour fournir une oxygénation suffisante aux personnes souffrant d'insuffisance respiratoire. Pour de plus amples informations, veuillez consulter le site abiomed.com.
DÉCLARATIONS PROSPECTIVES
Toutes les déclarations prospectives sont soumises à des risques et des incertitudes tels qu'ils sont décrits dans les rapports périodiques d'Abiomed déposés auprès de la Securities and Exchange Commission. Les résultats réels peuvent différer sensiblement des résultats anticipés.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Contacts
Contact avec les médias :
Jenny Leary
Directrice associée, communications, États-Unis
+1 (978) 882-8491
jleary@abiomed.com
Contact avec les investisseurs :
Todd Trapp
Vice-président exécutif et directeur financier
+1 (978) 646-1680
ttrapp@abiomed.com