Demographie- und klinikübergreifende Studie zu Impella behandelten Myokarditis-Patienten mit kardiogenem Schock in Japan ermittelte 30-Tage-Überlebensrate von 77 %
Demographie- und klinikübergreifende Studie zu Impella behandelten Myokarditis-Patienten mit kardiogenem Schock in Japan ermittelte 30-Tage-Überlebensrate von 77 %
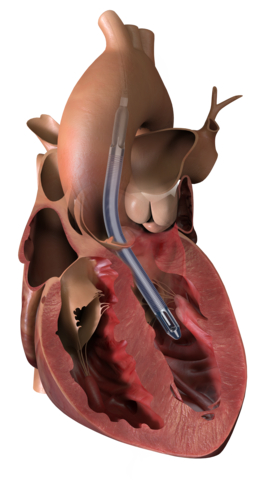
The Impella 5.5 with SmartAssist heart pump delivers full cardiac support, allowing the heart to rest and enabling the heart to achieve its natural pumping function without additional support. This heart pump is designed for long-duration support, enables patient mobility and optimizes recovery by using real-time intelligence. (Graphic: Business Wire)
BOSTON--(BUSINESS WIRE)--Abiomed (ABMD) präsentiert das Ergebnis einer dreijährigen, klinisch kontrollierten Studie, die in Japan unter ärztlicher Aufsicht in 109 Krankenhäusern mitüber Impella-behandelten Patienten durchgeführt wurde: Die 30-Tage-Überlebensrate von Patienten mit kardiogenem Schock aufgrund von Myokarditis betrug 77 %. Die Ergebnisseder Studie (eine Aktualisierung einer 2020 durchgeführten Zwischenanalyse), wurden im Rahmen der Transcatheter Cardiovascular Therapeutics (TCT) Konferenz 2022 in Boston veröffentlicht.
Für die Studie wurden 143 Patienten mit kardiogenem Schock aufgrund von Myokarditis in Folge untersucht. Die Patienten erhielten eine Behandlung mit der Impella- oder Impella mit zusätzlicher VA-ECMO-Unterstützung, auch ECpella genannt. Die Patienten sind im J-PVAD-Register eingetragen, einem von 10 japanischen Fachgremien wie u.a. der Japanese Circulation Society (JCS), geführten Register. Die Ergebnisse zeigten eine 30-Tage-Überlebensrate der Patienten von 77 %. Eine frühere Analyse von Myokarditis-Patienten, die lediglich eine VA ECMO-Unterstützung erhalten hatten, ergab eine 30-tägige Überlebensrate von 48 % (Journal of Heart and Lung Transplantation, 2021).
„Diese Ergebnisse belegen, dass der Einsatz von Impella bei Myokarditis-Patienten zu einer schnelleren Erholung des Herzens führen kann. Angesichts der begrenzten Zahl an Herztransplantationen ist dies ein wichtiger Aspekt“, so der ärtzliche StudienleiterDr. Koichi Toda, Herz- und Gefäßchirurg in der Abteilung für Herz- und Gefäßchirurgie an der Osaka University Graduate School of Medicine.
Myokarditis ist eine Herzmuskelentzündung die häufig durch eine Virusinfektion verursacht wird. Diese Entzündung kann die elektrische Aktivität des Herzens beeinträchtigen und zu einer Vergrößerung des Muskels führen - diese kann das Herz möglicherweise s weit schwächen, dass es härter arbeiten muss, um Blut und Sauerstoff in den Körper zu pumpen. Letzlich kann ein Herzversagen die Folge sein.
Einem Bericht des U.S. Centers for Disease Control and Prevention (CDC) zufolge sind die Myokarditisfäle- seit Beginn der COVID-19-Pandemie von <10 Fällen je 100.000 Menschen auf etwa 146 Fälle je 100.000 Menschen gestiegen. Der Bericht erläutert ferner, dass COVID-19 Patienten ein fast 16-fach höheres Risiko für eine Myokarditis aufweisen als Patienten, die nicht an COVID-19 erkrankt sind.
„Myokarditis entwickelt sich in Zeiten von COVID-19zu einer Epidemie. Interessant ist , dass die Studiendaten das Potenzial der Impella-Unterstützung zur Verbesserung der Patientenergebnisse in dieser schwerkranken Patientengruppe aufzeigen“, sagte Masahiro Ono, MD, Herz- und Gefäßchirurg bei Methodist Healthcare in San Antonio, Texas.
Im August 2020 hatte die US-amerikanische FDA eine Notfallzulassung (EUA) für linksseitige Impella-Herzpumpen zur Entlastung und Unterstützung des linken Ventrikels bei COVID-19-Patientenmit Lungenödem oder Myokarditis bei ECMO-Behandlung erlassen.
Eine durch COVID-19 verursachte Myokarditis mit einem kardiogenen Schock in Folge wurde beispielsweise im Januar 2022 bei dem 31-jährigen Bobby Goines diagnostiziert; einem Handelsvertreter aus Conway, Arkansas, USA. Der Patient – verheiratet und dreifacher Familienvater wurde am CHI St. Vincent Krankenhaus von Dr. Thurston Bauer eine Impella 5.5 mit SmartAssist zur Herzunterstützung und –entlastung implantiert. Nach achttägiger Behandlungsdauer – während dieser Zeit konnte Bobby Goines auf der Station herumgehen, während sich sein Zustand verbesserte - wurde die Impella abgesetzt und entfernt. Bobby Goines konnte mit normaler Herzfunktion nach Hause zurückkehren: Heute arbeitet er wieder und genießt die gemeinsame Zeit mit seiner Familie. Mehr über diese Patientengeschichte und Herzerholung finden Sie hier.
ÜBER IMPELLA HERZPUMPEN
Impella 2.5, Impella CP®, Impella CP mit SmartAssist, Impella 5.0®, Impella LD®, und Impella 5.5® mit SmartAssist® sind von der US-amerikanischen FDA zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock zugelassen. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können.
Die Impella Left Ventricular (LV) Support Systems sind außerdem für die Notfallverwendung durch medizinisches Fachpersonal im Krankenhaus zugelassen. Diese Systeme sollen eine vorübergehende (≤ 4 Tage für Impella 2.5, Impella CP und Impella CP mit SmartAssist und ≤ 14 Tage für Impella 5.0 und Impella 5.5 mit SmartAssist) LV-Entlastung und -Unterstützung zur Behandlung von Intensivpatienten mit bestätigter COVID-19-Infektion bewirken, die sich einer ECMO-Behandlung unterziehen und die während der V-A-ECMO-Unterstützung ein Lungenödem oder während der V-V-ECMO-Unterstützung eine späte kardiale Dekompensation aufgrund einer Myokarditis entwickeln. Die für die Notfallverwendung zugelassenen Impella LV Support Systems sind für die autorisierte Indikation weder freigegeben noch zugelassen. Die Impella RP and Impella LV Support Systems wurden von der FDA im Rahmen einer EUA für die oben genannte Notfallverwendung zugelassen und sind nur für die Dauer der Erklärung zugelassen, dass Umstände vorliegen, die die Zulassung der Notfallverwendung von Medizinprodukten gemäß Abschnitt 564(b)(1) des Gesetzes, 21 U.S.C. § 360bbb-3(b)(1), rechtfertigen, es sei denn, die Zulassung wird zu einem früheren Zeitpunkt beendet oder widerrufen.
ÜBER ABIOMED
Abiomed (Nasdaq: ABMD) mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung und Oxygenierung. Unsere Produkte entlasten das Herz durch die Verbesserung des Blutflusses und/oder stellen eine ausreichende Sauerstoffversorgung bei Patienten mit Atemwegsversagen sicher. Weitere Informationen erhalten Sie unter: http://www.abiomed.com.
ZUKUNFTSGERICHTETE AUSSAGEN
Zukunftsgerichtete Aussagen unterliegen Risiken und Unwägbarkeiten, wie sie in den periodischen Berichten von Abiomed, die bei der Securities and Exchange Commission hinterlegt sind, beschrieben werden. Die tatsächlichen Ergebnisse können erheblich von den erwarteten Ergebnissen abweichen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Contacts
Medienkontakt:
Jenny Leary
Associate Director, U.S. Communications
+1 (978) 882-8491
jleary@abiomed.com
Investorenkontakt:
Todd Trapp
Executive Vice President and Chief Financial Officer
+1 (978) 646-1680
ttrapp@abiomed.com