Weltweit kleinste Herzpumpe Impella ECP erhält „Breakthrough Device“ - Status von FDA
Weltweit kleinste Herzpumpe Impella ECP erhält „Breakthrough Device“ - Status von FDA
DANVERS, Massachusetts, USA--(BUSINESS WIRE)--Die US-amerikanische Aufsichtsbehörde FDA hat der expandierbaren perkutanen Impella ECP Herzpumpe von Abiomed (NASDAQ: ABMD) den Status als „Breakthrough Device“ („bahnbrechendes Gerät“) erteilt. Damit wird die FDA die regulatorischen Prüfverfahren für die Impella ECP Herzpumpe, einschließlich der Design-Iterationen, der klinischen Studienprotokolle und des Premarket Approval (PMA) - Antrags mit Vorrang bearbeiten.
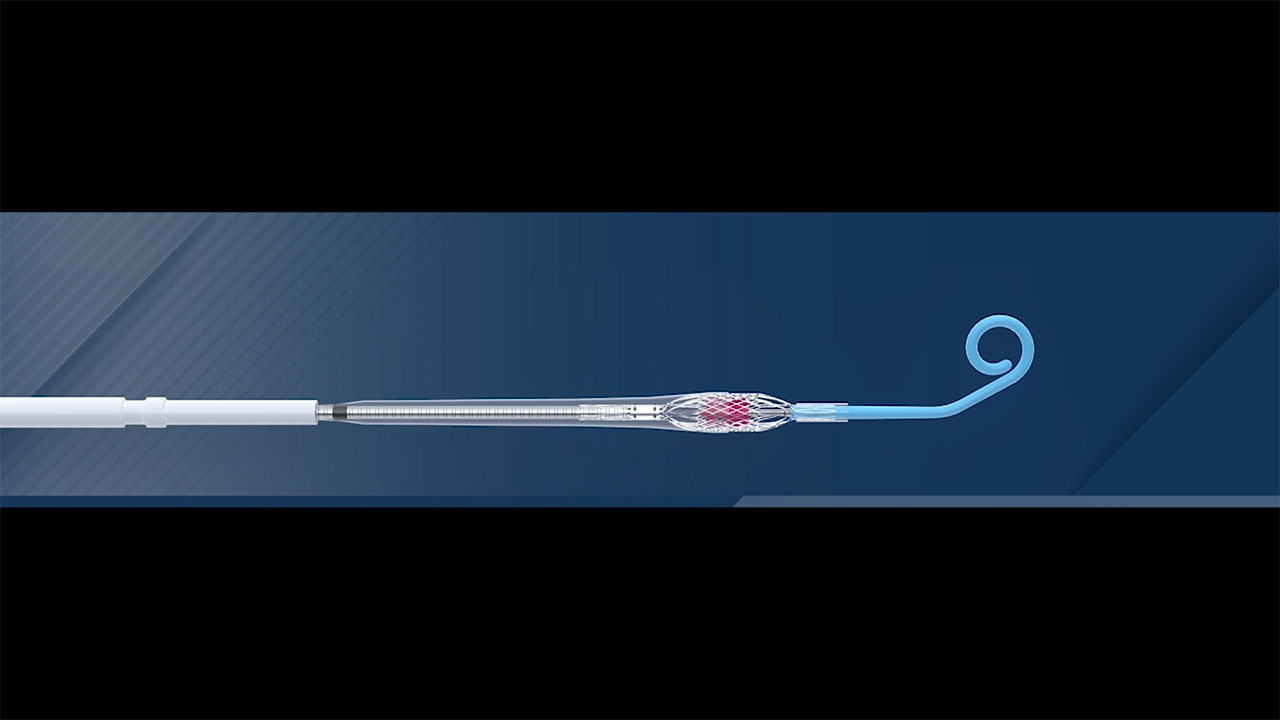
Die Impella ECP Herzpumpe ist die kleinste Herzpumpe der Welt und die erste, die mit kleinkalibrigen Zugängen und Verschlusstechniken kompatibel ist. Sie hat beim Einführen und Entfernen aus dem Körper einen Durchmesser von 9 French – dies entspricht 3 Millimetern. Im Herzen dehnt sie sich aus, um die Pumpfunktion des Herzens zu unterstützen und Volumenströme von mehr als 3,5 l/min zu ermöglichen.
Die FDA hat den „Breakthrough Device“ - Status unter anderem aufgrund der positiven klinischen Daten der ersten 21 Patienten erteilt, die im Rahmen einer von der FDA regulierten frühen Machbarkeitsstudie mit der Impella ECP Herzpumpe behandelt worden sind. Dabei stellte die FDA fest, dass die Impella ECP Herzpumpe die strengen FDA-Anforderungen für die Erteilung des „Breakthrough Device“ - Status erfüllt.
„Dies bedeutet eine weitere Validierung der klinischen Vorteile der Impella Technologie durch die FDA und bestätigt den innovativen Charakter der Impella ECP Herzpumpe. Aufgrund der geringeren Gefäßzugangsgröße hat die Impella ECP Herzpumpe das Potenzial, noch sicherere Behandlungsverfahren zu bieten und damit für eine größere Gruppe von Patienten zur Verfügung zu stehen, die hämodynamische Unterstützung für eine koronare Revaskularisation benötigen", so Dr. Chuck Simonton, Chief Medical Officer von Abiomed.
In den USA sind schätzungsweise 440.000 Patienten für eine Hochrisiko-PCI (Perkutane Koronarintervention) indiziert, die jedoch nicht ausreichend behandelt werden. Die geringe Größe der Impella ECP Herzpumpe könnte es mehr Ärzten ermöglichen, Patienten mit koronarer Herzkrankheit, die dies benötigen, entscheidende hämodynamische Unterstützung zu bieten.
Der erste Patient, der weltweit mit der Impella ECP Herzpumpe behandelt wurde, ist Robert Matthews, ein 80-jähriger pensionierter Automobilarbeiter aus Detroit, Vater von vier Kindern und Großvater von elf Kindern. Mehr als 20 Jahre lang lebte Robert Matthews mit einer Herzerkrankung und musste sich bereits mehreren Eingriffen unterziehen. Im Jahr 2020 wurde er an Dr. Amir Kaki überwiesen, einen interventionellen Kardiologen und Leiter der mechanischen Kreislaufunterstützung am Ascension St. John Hospital in Detroit. Dr. Kaki stellte mehrere Gefäßblockaden und eine schlechte Herzfunktion fest und identifizierte Robert Matthews als geeigneten Kandidaten für eine geschützte perkutane Koronarintervention mit der Impella Herzpumpe (Protected PCI). Dr. Kaki führte die Impella ECP Herzpumpe ein, öffnete die Gefäßblockaden und platzierte Stents. Damit war Robert Matthews der erste Patient weltweit, der mit der Impella ECP Herzpumpe behandelt wurde.
Bereits zwei Tage später wurde Robert Matthews nach Hause entlassen. Seine Familie und Freunde bemerkten sofort seine wiedererlangte Leistungsfähigkeit. Heute ist Robert Matthews dankbar für die hochmoderne Technologie, die ihm seine Lebensqualität zurückgegeben hat.
Warnhinweis: Die Impella ECP Herzpumpe ist ein Prüfprodukt, das durch US-Bundesgesetze auf Anwendungen zu Forschungszwecken beschränkt ist.
ÜBER IMPELLA HERZPUMPEN
Die Impella 2.5® und Impella CP® Herzpumpen sind von der FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen zugelassen, die einer elektiven oder dringlichen perkutanen Koronarintervention (PCI: Percutaneous Coronary Intervention) wie z. B. Stentimplantation oder Ballon-Angioplastie unterzogen werden.
Die Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5® mit Smart Assist® Herzpumpen sind von der FDA zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock zugelassen und ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung und Oxygenierung. Unsere Produkte entlasten das Herz durch die Verbesserung des Blutflusses und stellen eine ausreichende Sauerstoffversorgung bei Patienten mit Atemwegsversagen sicher. Weitere Informationen sind abrufbar unter: www.abiomed.com.
ZUKUNFTSGERICHTETE AUSSAGEN
Zukunftsgerichtete Aussagen unterliegen Risiken und Ungewissheiten, wie sie in den periodischen Berichten von Abiomed, die bei der Securities and Exchange Commission hinterlegt sind, beschrieben werden. Die tatsächlichen Ergebnisse können erheblich von den erwarteten Ergebnissen abweichen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Contacts
Ansprechpartner bei Rückfragen:
Tom Langford
Director of Communications
978-882-8408
tlangford@abiomed.com