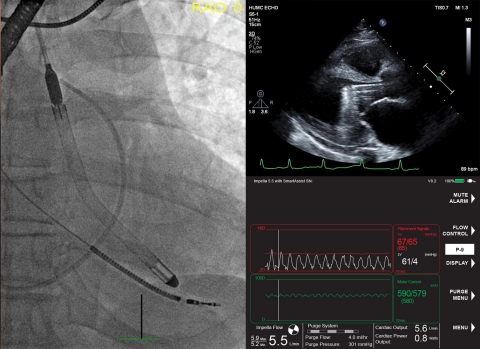
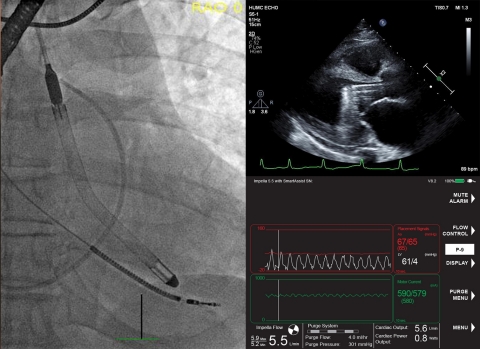
DANVERS, Massachusetts, USA--(BUSINESS WIRE)--Laut der ersten in den USA veröffentlichten Studie von Patienten, die die neueste Herzpumpe von Abiomed, die Impella 5.5 mit SmartAssist, erhalten haben, überlebten 84 Prozent der Patienten bis zur Explantation mit einer Wiederherstellung der nativen Herzfunktion von 76 Prozent. Die Studie wurde in der Juliausgabe des American Society for Artificial Internal Organs (ASAIO) Journal veröffentlicht.
Die Studie untersuchte die Ergebnisse der ersten 55 Patienten, die in der Cleveland Clinic, im Hackensack University Medical Center/Hackensack Meridian Health und im Cedars-Sinai Medical Center mit der Impella 5.5 mit SmartAssist behandelt wurden. Die Autoren der Studie, die Herzchirurgen Dr. med. Ed Soltesz, Dr. med. Mark Anderson und Dr. med. Danny Ramzy, kommen zu dem Schluss, dass die Impella 5.5 mit SmartAssist bei einer Reihe anspruchsvoller klinischer Szenarien, zu denen auch der kardiogene Schock bei AMI zählt, sicher und wirksam eingesetzt werden kann.
„Dieser Bericht belegt den Nutzen einer Entlastung von Patienten mit kardiogenem Schock. Es ist ermutigend, dass die in der Praxis beim Einsatz von Impella 5.5 mit SmartAssist gewonnenen Daten verbesserte Überlebensraten aufzeigen“, so Dr. med. Danny Ramzy, Assistenzprofessor, chirurgischer Direktor des Lungentransplantationsprogramms und Direktor für robotergestützte und minimalinvasive Herzchirurgie am Cedars-Sinai Medical Center. „Der kontinuierliche Einsatz von Best Practices, bewährten Verfahren und innovativen Technologien wie Impella ermöglicht uns eine bessere Patientenversorgung, die zu optimalen Behandlungsergebnissen und höherer Lebensqualität führen.“
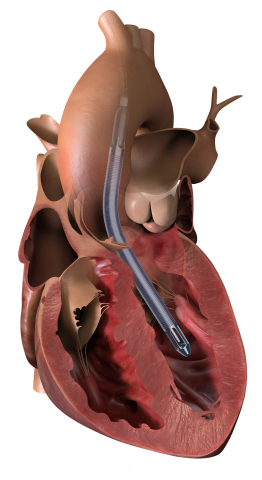
Im September 2019 hat Impella 5.5 mit SmartAssist von der FDA die PMA-Zulassung für Sicherheit und Wirksamkeit bei der Behandlung von Patienten mit kardiogenem Schock für bis zu 14 Tage erhalten. Diese mikroaxiale, chirurgisch vorübergehend implantierte Herzpumpe entlastet das linke Ventrikel, reduziert die ventrikuläre Belastung und unterstützt den Kreislauf, um eine native Erholung des Herzens und eine frühzeitige Evaluierung der verbleibenden Myokardfunktion zu ermöglichen. Ihre Vorteile umfassen:
- Leichte Einführung über die Arteria axillaris oder die Aorta anteriora
- Für die Langzeitunterstützung mit langlebigen Keramiklagern, ohne Pigtail zur Minimierung von Adhäsionen, für eine leichte Patientenmobilisierung
- Vorwärtsfluss mit maximaler Entladung zur Durchblutung der Endorgane und zur koronaren Durchblutung bei gleichzeitiger Erholung des Herzens
- Besseres Patientenmanagement mit intelligenter Gerätepositionierung, intelligentem Management und intelligenter Entwöhnung dank SmartAssist-Technologie
- Ausgestattet mit Impella Connect, einer cloud-basierten Beobachtungs- und Kooperationsplattform für das Patientenmanagement, die eine Fernüberwachung der Impella-Konsole ermöglicht. Während der COVID-19-Krise können medizinische Fachkräfte diesen HIPAA-konformen Online-Überwachungsdienst kostenlos nutzen, um Patienten rund um die Uhr zu betreuen.
Bei den 55 an der Studie beteiligten Patienten wurde Impella 5.5 mit SmartAssist zwischen dem 16. Oktober 2019 und dem 4. März 2020 implantiert. Die Autoren der Studie stellten insbesondere Folgendes fest:
- 35 Patienten (63,6 %) wurden erfolgreich von der Technologie entwöhnt.
- 11 Patienten (20,0 %) erhielten eine weitere Therapie, zwei Patienten (3,6 %) verstarben während der Unterstützung und bei sieben Patienten (12,7 %) wurde die Behandlung abgebrochen.
- Bei 76,1 % der überlebenden Patienten erholte sich die native Herzfunktion.
- Es wurden keine gerätebedingten Infarkte, keine Hämolyse und keine Gliedmaßenischämie beobachtet.
- Die Ergebnisse zeigen, dass Impella ein zuverlässiges System für die akute mechanische Kreislaufunterstützung für bedürftige Patienten ist, da das System ihre Hämodynamik während der Behandlung stabilisiert.
ÜBER IMPELLA-HERZPUMPEN
Die Geräte Impella 2.5® und Impella CP® haben die PMA-Zulassung der US-amerikanischen Arzneimittelbehörde FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen erhalten, die sich einer elektiven und dringlichen perkutanen Koronarintervention (PCI) wie etwa einer Stentimplantation oder Ballonangioplastie unterziehen, um blockierte Koronararterien zu öffnen. Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5® mit Smart Assist® sind von der FDA zugelassene Herzpumpen zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können. Die Impella RP® ist von der FDA zur Behandlung von Rechtsherzinsuffizienz oder -dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, nach einem Myokardinfarkt, einer Herztransplantation oder einer Operation am offenen Herzen zugelassen. Die Impella RP darf außerdem im Rahmen eines Notfalleinsatzes von medizinischem Fachpersonal im Krankenhaus zur vorübergehenden rechtsventrikulären Unterstützung für die Dauer von bis zu 14 Tagen bei Intensivpatienten mit einer Körperoberfläche von ≥ 1,5 m2 zur Behandlung einer akuten Rechtsherzinsuffizienz oder Dekompensation aufgrund von Komplikationen im Zusammenhang mit der Coronavirus-Erkrankung 2019 (COVID-19), einschließlich Lungenembolie (PE), eingesetzt werden. Die Impella RP ist weder für die Behandlung der akuten Rechtsherzinsuffizienz noch für die Behandlung der Dekompensation aufgrund von Komplikationen im Zusammenhang mit COVID-19 freigegeben oder zugelassen. Die Impella RP wurde von der FDA im Rahmen einer EUA für einen oben genannten Notfalleinsatz nur für die Geltungsdauer der Erklärung zugelassen, dass Umstände vorliegen, die die Notfallgenehmigung medizinischer Geräte gemäß Abschnitt 564(b)(1) von Act 21 U.S.C. § 360bbb-3(b)(1) begründen, es sei denn, die Zulassung wird früher beendet oder widerrufen.
In Europa sind Impella 2.5, Impella CP und Impella CP mit SmartAssist für eine bis zu fünftägige Behandlung von Hochrisiko-PCI- und AMI-Patienten mit kardiogenem Schock CE-zertifiziert. Impella 5.0 und Impella LD sind CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten bei kardiogenem Schock bis zu 10 Tage lang zu behandeln. Die Impella 5.5 mit SmartAssist ist CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten bei kardiogenem Schock bis zu 30 Tage lang zu behandeln. Die Impella RP ist CE-gekennzeichnet, um Rechtsherzversagen oder -dekompensation nach Implantation des linksventrikulären Unterstützungssystems, Myokardinfarkt, Herztransplantation, Operation am offenen Herzen oder refraktärer ventrikulärer Arrhythmie zu behandeln.
Weitere Informationen über die Impella-Herzpumpenplattform, einschließlich der zugelassenen Indikationen und wichtiger Sicherheits- und Risikoinformationen zur Anwendung der Geräte, finden Sie unter www.impella.com.
ÜBER ABIOMED
Abiomed Inc. mit Sitz in Danvers, Massachusetts, USA, ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung. Unsere Produkte sollen durch die Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens die Erholung des Herzens ermöglichen. Weitere Informationen finden Sie unter: www.abiomed.com.
Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist und Impella Connect sind eingetragene Marken von Abiomed, Inc. und in den USA sowie in bestimmten anderen Ländern eingetragen. Impella BTR, Impella ECP, CVAD Study und STEMI DTU Study sind angemeldete Marken von Abiomed Inc.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter auch in Bezug auf die Entwicklung bereits bestehender und neuer Produkte von Abiomed, das kommerzielle Wachstum des Unternehmens, zukünftige Geschäftsmöglichkeiten und ausstehende regulatorische Genehmigungen. Die tatsächlichen Ergebnisse des Unternehmens können sich aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen erwarteten Ergebnissen unterscheiden, darunter Unwägbarkeiten im Zusammenhang mit Umfang, Ausmaß und Dauer der Auswirkungen der COVID-19-Pandemie, mit der Entwicklung, Prüfung und damit verbundenen regulatorischen Genehmigungen, einschließlich der Möglichkeit künftiger Verluste, mit komplexer Herstellung, hohen Qualitätsanforderungen, Abhängigkeit von begrenzten Bezugsquellen, Wettbewerb, technologischen Veränderungen, staatlichen Auflagen, Rechtsstreitigkeiten, künftigem Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie anderen Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission (SEC) hinterlegten Unterlagen des Unternehmens, einschließlich des neuesten Jahresberichts auf Formblatt 10-K und der nachfolgend bei der SEC eingereichten Unterlagen. Den Lesern dieser Pressemitteilung wird geraten, zukunftsgerichtete Aussagen, die ausschließlich den Informationsstand am Tag der Veröffentlichung widerspiegeln, nicht als verlässliche Informationen zu bewerten. Das Unternehmen ist nicht verpflichtet, Aktualisierungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, die Ereignisse oder Umstände widerspiegeln, die nach dem Zeitpunkt der Veröffentlichung eintreten oder durch die Einwirkung unvorhersehbarer Ereignisse zustande kommen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.