NEW ORLEANS, Louisiana--(BUSINESS WIRE)--Abiomed (NASDAQ:ABMD), ein führender Anbieter bahnbrechender Technologien zur Unterstützung der Herzfunktion und Hersteller der Herzpumpe Impella RP, gibt bekannt, dass die Überlebensdaten aus der 18-monatigen Post-Zulassungsstudie mit 42 Impella-RP-Patienten auf der 68. wissenschaftlichen Jahrestagung des American College of Cardiology (ACC) in New Orleans vorgelegt wurden. Impella RP ist die einzige perkutan angewendete Technologie zur Unterstützung der rechten Herzkammer mit FDA PMA-Zulassung, die als sicher und wirksam bezeichnet wird. In nachstehender Tabelle sind die aktuellsten nach der Markteinführung gesammelten Studiendaten zusammengefasst und den der FDA im Hinblick auf die PMA-Zulassung von Impella RP vorgelegten Daten gegenübergestellt.
|
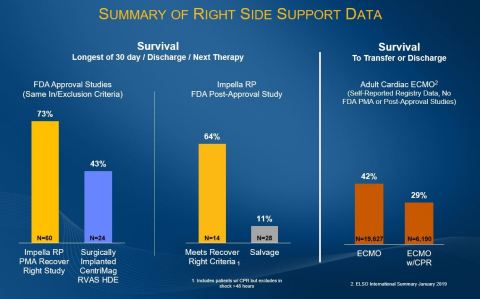
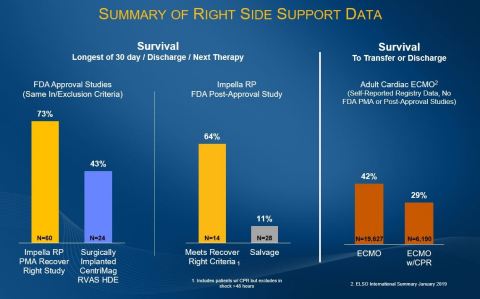
Ergebnisse der PAS-Studie (Post-Zulassung) von Impella RP mit und ohne Recover Right-Protokoll |
|||||||||
|
Post-Zulassungsstudie (PAS) – (N=42) |
Überlebensraten |
||||||||
|
Recover Right-Protokoll Probandengruppe (N=14) |
64 % (9/14) |
||||||||
|
Salvage-Probandengruppe (N=28) |
11 % (3/28) |
||||||||
|
American College of Cardiology Scientific Session, 2019 |
|||||||||
|
PMA-Studienergebnisse (vor der Marktzulassung) mit Recover Right-Protokoll |
|||||||||
|
Überlebensraten |
|||||||||
|
PMA-Probanden (RR + CAP + HDE PAS) – gesamte Kohorte (N=60) |
73 % (44/60) |
||||||||
|
Kohorte A – LVAD-Patienten (N=31) |
77 % (24/31) |
||||||||
|
Kohorte B – Schockpatienten (N=29) |
69 % (20/29) |
||||||||
|
Journal of Heart and Lung Transplant, Dezember 2018 (37) |
|||||||||
Die Daten der Post-Zulassungsstudie wurden überprüft und der FDA am Mittwoch, den 13. März 2019 von Abiomed vorgelegt. Die FDA hat die Klassifizierung der Patienten in zwei Kategorien bestätigt: Recover-Right-Protokoll und Salvage-Support. Das Recover-Right-Protokoll umfasst Patienten, die die Aufnahme- und Ausschlusskriterien der klinischen Studie Recover Right FDA PMA für Impella RP erfüllten. Die FDA erkennt auch an, dass Salvage-Patienten sich außerhalb des Recover-Right-Protokolls (>48 Stunden in kardiogenem Schock aufgrund von Rechtsherzinsuffizienz) befinden.
Die Kennzeichen der beiden Patientengruppen waren bei Studienbeginn unterschiedlich, mit höherer Mortalität in der Salvage-Gruppe. Salvage-Patienten gehören zu den schwächsten Patienten in der Klinik und haben in vielen Fällen außerhalb des Krankenhauses einen Herzstillstand erlitten oder sind unter Umständen vor dem Einsatz von Impella RP an mehrere Krankenhäuser überwiesen worden. Die FDA und Abiomed sind der Auffassung, dass Ärzte die Möglichkeit haben sollten, bei diesen Patienten lebensrettende Maßnahmen nach ihrer besten Einschätzung zu ergreifen. Tim Deits, ein 16-jähriger Impella-RP-Patienten aus Huntington Beach in Kalifornien (USA), ist ein Beispiel eines extrem schwerkranken Patienten, der einen unbeobachteten Herzstillstand außerhalb des Krankenhauses erlitt, wiederbelebt wurde und unter Erholung seines eigenen Herzens überlebte.
Die Daten der Post-Zulassungsstudie zu Impella RP stehen im Vergleich zu einer Überlebensrate von 73 Prozent in der Impella RP PMA-Studie, 42 Prozent bei dem Studienprotokoll mit chirurgisch implantiertem CentriMag RVAS HDE und 29 bis 42 Prozent anamnestisch berichtetes Überleben zur Überweisung oder Entlassung bei erwachsenen Herz-ECMO-Patienten1. Zu beachten ist, dass das Recover-Right-Protokoll dem von der FDA als Rechtsherzinsuffizienz eingestuften chirurgischen CentriMag-Protokoll entspricht. Impella RP ist das einzige Gerät, zu dem Daten aus einer Post-Zulassungsstudie mit Behandlungsergebnissen aus der klinischen Praxis vorgelegt wurden, einschließlich Einsatz in Salvage-Fällen. Die Patientenpopulation wird in der laufenden cVAD-Studie weiter geprüft.
„Bei Rechtsherzinsuffizienz gestattet Impella RP eine Entlastung des Herzens und die Wiedergewinnung seiner Fähigkeit, Blut durch den Körper zu pumpen“, erklärte Dr. med. David Wohns, MD, Chief of Cardiology bei Spectrum Health. „Impella RP ist eine wirksame Behandlung für Patienten, bei denen sie rechtzeitig implantiert wird und die die Aufnahme- bzw. Ausschlusskriterien für Recover Right erfüllen.“
„Die Daten aus der Post-Zulassungsstudie stehen im Einklang mit unseren eigenen unabhängig gewonnenen Daten aus mehreren Kliniken in der Cardiogenic Shock Working Group, in denen eine rund 80-prozentige Überlebensrate festgestellt wurde, wenn Impella RP bei Patienten mit kardiogenem Schock, die die Aufnahmekriterien aus der Recover-Right-Studie erfüllten, eingesetzt wurde“, so Dr. med. Navin Kapur, MD, Executive Director des CardioVascular Center for Research and Innovation beim Tufts Medical Center. „Derartige Daten unterstreichen, wie die Nutzung von Algorithmen zur Erkennung der Rechtsherzinsuffizienz und Protokolle für frühe hämodynamische Unterstützung die Ergebnisse für Patienten mit kardiogenem Schock verbessern können.“
Abiomed empfiehlt Klinikern, die geeigneten Aufnahme- bzw. Ausschlusskritierien für Impella RP zu beachten und die Richtlinien einzuhalten, denen zufolge die Implantation von Impella RP innerhalb von 48 Stunden nach dem Beginn des von Rechtsherzinsuffizienz verursachten kardiogenen Schocks empfohlen wird. Darüber hinaus empfiehlt Abiomed auch die Anwendung bewährter Verfahren, etwa der National Cardiogenic Shock Initiative und der Shock Care Pathway Algorithms. Abiomed verpflichtet sich der Verbesserung von Behandlungsergebnissen durch Führungsarbeit in der Datenerfassung in unserer kommerziellen IQ-Datenbank und Post-Zulassungsstudien cVAD, um empfehlenswerte Verfahren zu ermitteln und zu bestätigen.
ÜBER DIE IMPELLA-HERZPUMPE
Die Modelle Impella 2.5 und Impella CP sind von der FDA für die Behandlung bestimmter Patienten mit fortgeschrittener Herzinsuffizienz zugelassen, die sich elektiven und dringenden perkutanen Koronareingriffen (PCI) unterziehen, beispielsweise Stenteinlage oder Ballonangioplastie, um verstopfte Herzkranzgefäße wieder zu öffnen. Die Modelle Impella 2.5®, Impella CP®, Impella CP® mit SmartAssist, Impella 5.0® und Impella LD® sind von der FDA zugelassene Herzpumpen, die zur Behandlung von Patienten mit Herzinfarkt oder Kardiomyopathie in kardiogenem Schock eingesetzt werden. Sie weisen die einzigartige Fähigkeit auf, die native Herzfunktion wiederherzustellen, so dass die Patienten mit ihrem eigenen Herzen nach Hause zurückkehren können. Das Modell Impella RP® ist von der FDA für die Behandlung von Patienten mit akuter Rechtsherzinsuffizienz oder -dekompensation nach der Implantation von linksventrikulären Unterstützungssystemen, Myokardinfarkten, Herztransplantationen oder Operationen am offenen Herzen zugelassen. Weitere Informationen über die Impella-Herzpumpen und ihre zugelassenen Indikationen sowie wichtige Informationen zur Sicherheit und zu den Risiken in Verbindung mit der Verwendung dieser Geräte finden Sie unter: www.protectedpci.com.
Das Abiomed-Logo, Abiomed, Impella, Impella 2.5, Impella 5.0, Impella LD, Impella CP, Impella RP, Impella Connect und Recovering Hearts. Saving Lives. sind eingetragene Marken von Abiomed, Inc. in den USA und in bestimmten anderen Ländern.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA) ist ein führender Anbieter von Medizingeräten zur Kreislaufunterstützung. Unsere Produkte dienen dazu, das Herz zu entlasten, indem der Blutfluss verbessert bzw. die Pumpfunktion des Herzens übernommen wird. Weitere Informationen erhalten Sie unter: www.abiomed.com.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter Aussagen bezüglich der Entwicklung bestehender und neuer Produkte von Abiomed, des Fortschritts des Unternehmens beim kommerziellen Wachstum sowie künftiger Chancen und erwarteter aufsichtsrechtlicher Genehmigungen. Die tatsächlichen Ergebnisse des Unternehmens können sich aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen erwarteten Ergebnissen unterscheiden, darunter Unsicherheiten in Verbindung mit der Entwicklung, Prüfung und damit verbundenen regulatorischen Genehmigungen, einschließlich der Möglichkeit künftiger Verluste, komplexe Herstellung, hohe Qualitätsanforderungen, Abhängigkeit von begrenzten Versorgungsquellen, Wettbewerb, technologische Veränderungen, staatliche Auflagen, Rechtsstreitigkeiten, künftiger Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie andere Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission hinterlegten Unterlagen des Unternehmens, darunter der neueste Jahresbericht auf Formblatt 10-K und der aktuelle Quartalsbericht auf Formblatt 10-Q, näher ausgeführt werden. Leser werden davor gewarnt, sich nicht über Gebühr auf solche zukunftsgerichteten Aussagen zu verlassen, da diese nur für den Zeitpunkt der Veröffentlichung dieser Mitteilung gelten. Das Unternehmen übernimmt keine Verpflichtung, die Ergebnisse möglicher Überprüfungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, um nach dem Datum dieser Pressemitteilung eingetretene Ereignisse oder das Eintreten von unerwarteten Ereignissen widerzuspiegeln.
1 2019 ELSO International Summary
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.