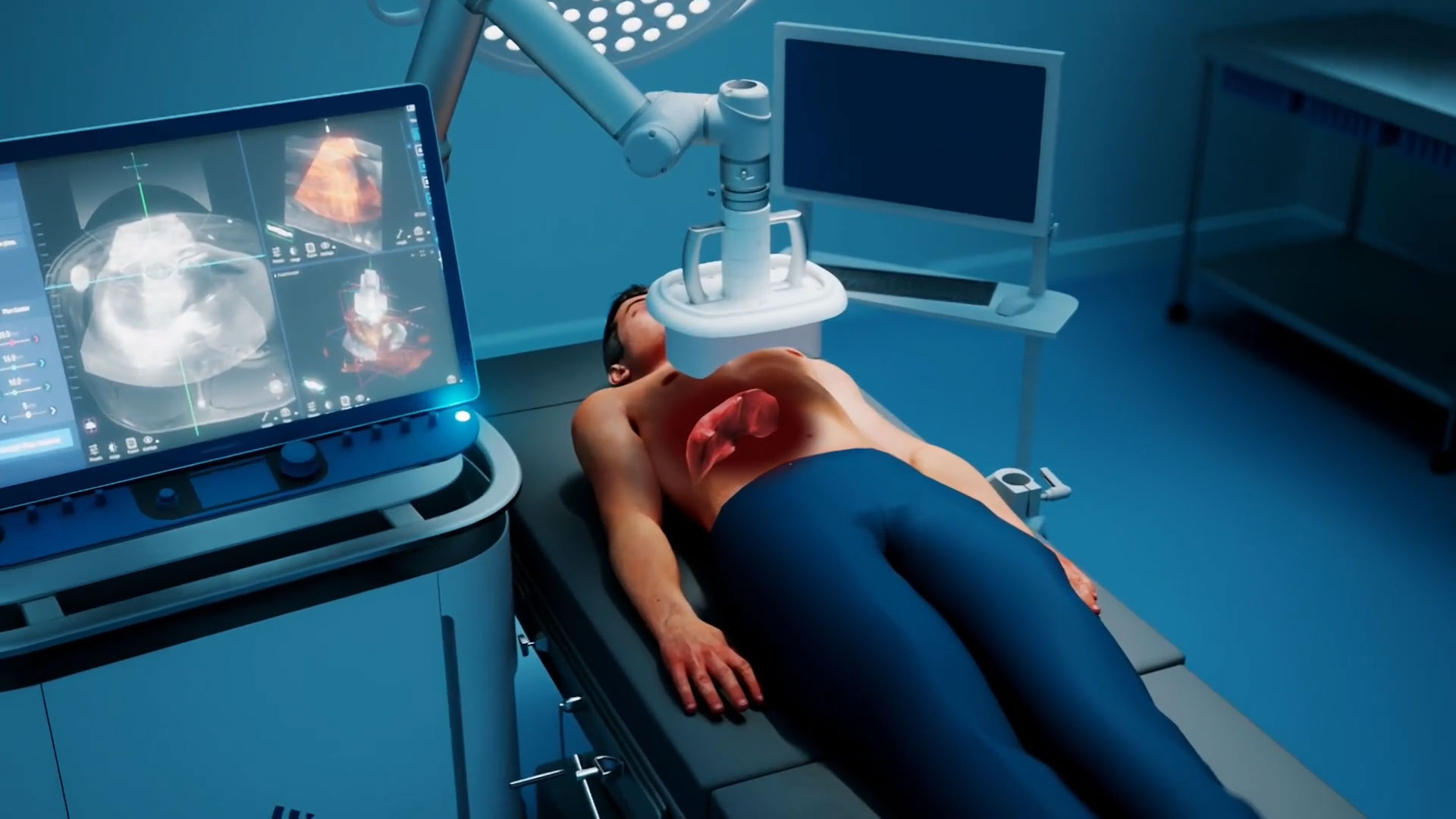
MINNEAPOLIS--(BUSINESS WIRE)--HistoSonics, le développeur et fabricant du système Edison® Histotripsy, a annoncé aujourd'hui que les premiers patients ont été recrutés dans le cadre de leur nouvelle étude prospective à protocole maître, appelée BOOMBOX. Cette étude est destinée à évaluer l'utilisation en conditions réelles de l'histotripsie pour le traitement des tumeurs hépatiques. BOOMBOX est une étude post-commercialisation complète qui fournira des données importantes pour 5 000 patients traités à travers une base mondiale croissante de prestataires multidisciplinaires en histotripsie. Ce protocole maître est unique dans l'industrie des dispositifs médicaux, car il recueille des données de traitement sur divers types de tumeurs et stades de maladie chez des patients aux besoins interventionnels variés, et ce, dans plusieurs spécialités cliniques.
« En temps normal, cette complexité aurait nécessité plusieurs protocoles d'études distincts sur une longue période, retardant ainsi l'accès à l'histotripsie pour les patients dans le besoin », a déclaré Amanda Cafaro, vice-présidente des affaires cliniques chez HistoSonics. « Nous avons conçu cette étude post-commercialisation à protocole maître ainsi que ses sous-études pour rapidement appréhender de nombreuses questions de recherche cliniquement pertinentes, tout en accélérant l'accès à cette thérapie innovante. »
Le critère d'évaluation principal de BOOMBOX permettra d'examiner la capacité de l'histotripsie en tant qu'outil polyvalent et les sous-études ultérieures évalueront des critères d'évaluation supplémentaires afin de définir des objectifs de traitement de plus en plus spécifiques : en tant que monothérapie, thérapie combinée, à visée curative, ainsi que comme préparation à d'autres traitements. L'inscription pour l'étude BOOMBOX a commencé dans plusieurs centres de traitement clinique en histotripsie aux États-Unis, et l'entreprise s'attend à une participation de sites d'histotripsie à la fois américains et internationaux.
« L'histotripsie représente un traitement novateur pour mes patients souffrant de tumeurs hépatiques et a déjà démontré un profil bénéfice-risque optimisé d'une manière cliniquement satisfaisante », a déclaré Juan P. Rocca, M.D., MHA, directeur chirurgical du programme de cancer du foie du New York-Presbyterian et du Weill Cornell Medicine, l'un des centres du pays proposant l'histotripsie. « En participant à l'étude BOOMBOX, nous nous engageons dans une recherche pratique et réelle qui favorisera l'avancement de cette plateforme innovante et explorera de nouvelles façons d'utiliser l'histotripsie à l'avenir. Participer à BOOMBOX est exactement le type de recherche pratique qui continuera à faire progresser cette nouvelle plateforme révolutionnaire et nous aidera à trouver des moyens nouveaux et innovants d'utiliser l'histotripsie dans le futur. »
« L'ampleur et la diversité des données que nous recueillerons dans le cadre de l'étude BOOMBOX nous fourniront, ainsi qu'à nos partenaires du programme d'histotripsie, des informations sur la manière dont l'histotripsie pourrait impacter les patients atteints de diverses maladies et conditions. BOOMBOX est le fruit de notre engagement à long terme pour comprendre comment l'histotripsie peut améliorer la vie des patients victimes de tumeurs du foie et des symptômes débilitants auxquels ils sont confrontés », a déclaré Joe Herman, MD, vice-président des affaires médicales, HistoSonics.
L'étude BOOMBOX marque le début des efforts de HistoSonics pour générer des preuves post-commercialisation concernant le foie, après la récente publication des essais cliniques pivots #HOPE4LIVER de la société, qui ont été soumis à la Food and Drug Administration (FDA) des États-Unis dans le cadre de la demande d'accès au marché de HistoSonics. Cela a conduit à l'octroi du statut De Novo par la FDA en octobre 2023 pour la destruction non invasive des tumeurs hépatiques via l'histotripsie. En plus de l'étude maîtresse BOOMBOX, HistoSonics a mis en place un programme de recherche parrainé par des investigateurs afin de soutenir la recherche indépendante avec des prestataires d'histotripsie grâce à des subventions, favorisant ainsi une utilisation sûre et efficace de l'histotripsie.
Le système Edison est destiné à la destruction mécanique non invasive des tumeurs hépatiques, dont la destruction partielle ou complète des tumeurs hépatiques non résécables via l'histotripsie. La FDA n'a pas évalué le système Edison pour le traitement de toute maladie, y compris, mais sans s'y limiter, le cancer, ni évalué des résultats spécifiques liés au cancer (comme la progression locale de la tumeur, la survie à 5 ans ou la survie globale). Le système ne doit être utilisé que par des médecins ayant suivi la formation dispensée par HistoSonics, et son utilisation doit être guidée par le jugement clinique d'un médecin formé de façon adéquate. Consultez les instructions d'utilisation de l'appareil pour obtenir une liste complète des avertissements, des précautions et un résumé des résultats des essais cliniques, notamment les événements indésirables signalés. »
À propos de HistoSonics
HistoSonics est une entreprise privée de dispositifs médicaux qui développe une plateforme non invasive et une thérapie exclusive par faisceau sonique utilisant la science de l'histotripsie, un nouveau mécanisme d'action qui utilise des ultrasons focalisés pour détruire de manière mécanique et liquéfier les tissus indésirables et les tumeurs. La société se concentre actuellement sur la commercialisation de son système Edison aux États-Unis et dans d'autres marchés pour le traitement du foie, tout en élargissant les applications d'histotripsie à d'autres organes, notamment les reins et le pancréas. Les bureaux de HistoSonics sont situés à Ann Arbor, dans le Michigan, et à Minneapolis, dans le Minnesota.
Pour plus d'informations sur l'étude BOMBOX, veuillez vous référer au document NCT06486454 à l'adresse : BOOMBOX Study Information at ClinicalTrials.gov. Pour plus d'informations sur le système d'histotripsie d’Edison, veuillez consulter : www.histosonics.com/. Pour des informations relatives aux patients, veuillez consulter : www.myhistotripsy.com/.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.