TORONTO--(BUSINESS WIRE)--Cybin Inc. (NYSE American:CYBN) (Cboe CA:CYBN) (“ Cybin ” oder das “ Unternehmen ”), ein im klinischen Stadium befindliches biopharmazeutisches Unternehmen, das sich der Revolutionierung der psychischen Gesundheitsfürsorge durch die Entwicklung neuer und innovativer psychedelischer Behandlungsmöglichkeiten der nächsten Generation verschrieben hat, gab heute bekannt, dass die FDA die BTD für CYB003 erteilt hat, sein proprietäres deuteriertes Psilocybin-Analogon, das sich in der Entwicklung für die begleitende Behandlung von MDD befindet. Sollte CYB003 von der FDA zugelassen werden, wäre es das erste bekannte psychedelische Zusatztherapeutikum zur Behandlung von MDD.
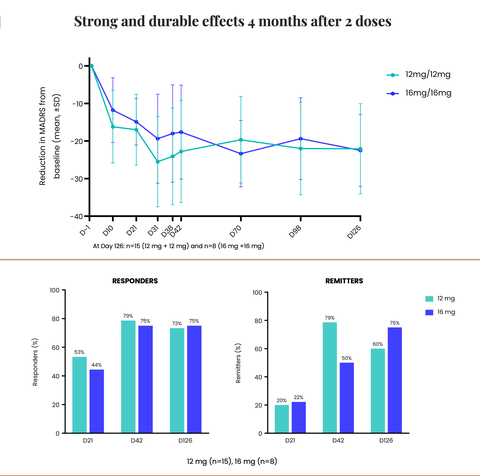
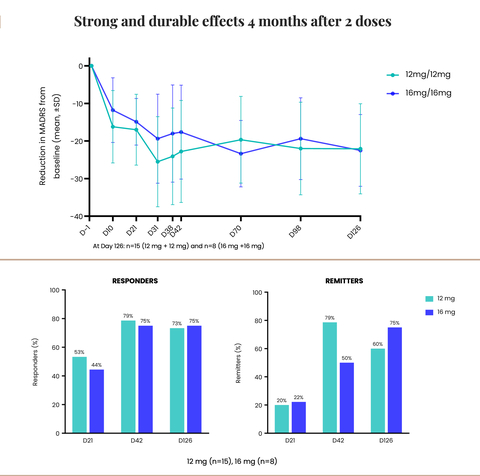
Das Unternehmen gab außerdem bekannt, dass seine Phase 2-Studie mit CYB003 bei MDD eine robuste und anhaltende Verbesserung der Depressionssymptome nach vier Monaten gezeigt hat, wobei 75% der Teilnehmer, die zwei 16mg-Dosen erhielten, eine Remission erreichten und keine Anzeichen einer Depression mehr zeigten.
Diese bedeutenden Meilensteine spiegeln das Engagement des Unternehmens wider, innovative Behandlungsmöglichkeiten für MDD voranzutreiben, und markieren einen entscheidenden Moment bei der Erlangung der Marktzulassung.
Breakthrough Therapy Designation (BTD) beschleunigt und entschärft den Weg nach vorn6
Die BTD bietet einen beschleunigten Prüfpfad sowie einen verbesserten Zugang zu FDA-Leitlinien für das Studiendesign und hat das Potenzial, die Zeitspanne für die Entwicklung von Medikamenten zu verkürzen. Er ist Arzneimittelkandidaten vorbehalten, die auf schwerwiegende Erkrankungen abzielen und bei einem klinisch bedeutsamen Endpunkt eine wesentliche Verbesserung gegenüber verfügbaren Therapien aufweisen. Die Ernennung beinhaltet alle Merkmale des "Fast Track"-Programms sowie intensivere FDA-Anleitungen und Diskussionen über das CYB003-Entwicklungsprogramm, einschließlich geplanter klinischer Studien und Pläne zur Beschleunigung der Produktionsentwicklungsstrategie.
Die Einstufung von CYB003 als bahnbrechende Therapie erkennt den erheblichen ungedeckten medizinischen Bedarf für wirksamere Behandlungen von MDD an und unterstützt das Potenzial von CYB003 für signifikante Verbesserungen gegenüber bestehenden Therapien. Die BTD dient als Bestätigung der bisherigen Fortschritte des Unternehmens und wird voraussichtlich Cybins Mission beschleunigen, seine firmeneigene Behandlung der nächsten Generation in Richtung einer beschleunigten Zulassung als neues Medikament voranzutreiben.
Diese Ernennung wird durch die positiven Ergebnisse der Phase-2-Studie des Unternehmens zu CYB003 bei MDD unterstützt, die eine Verbesserung der Depressionssymptome zeigten, die den zugelassenen Antidepressiva überlegen war, sowie durch kürzlich gemeldete Daten mit anderen Psychedelika. 1
"Es ist ein Beweis für die harte Arbeit und das Engagement des gesamten Cybin-Teams, dass wir so schnell so viel erreicht haben. Die Erteilung der Breakthrough Therapy Designation durch die FDA unterstreicht das Potenzial von CYB003, eine Lücke in der Behandlungslandschaft für MDD zu schließen und dient dazu, unser Entwicklungsprogramm zu beschleunigen und das Risiko zu verringern", sagte Doug Drysdale, Chief Executive Officer von Cybin. "Diese Ausweisung ermöglicht ein gestrafftes Prüfverfahren und eine verstärkte Zusammenarbeit mit der FDA. Mit den robusten Haltbarkeitsdaten aus unserer Phase-2-Studie in der Hand sind wir bereit, zügig voranzukommen. Wir sind dankbar für die Möglichkeit, die Entwicklung und den behördlichen Überprüfungsprozess zu beschleunigen, die uns diese Ernennung bietet, während wir uns darauf vorbereiten, CYB003 in Richtung einer Phase-3-Zulassungsstudie gegen Mitte des Jahres voranzubringen".
"Die derzeit verfügbaren Standardbehandlungen für MDD können in Bezug auf Wirksamkeit, Remissions- und Ansprechraten begrenzt sein, was sowohl für Patienten als auch für Psychotherapeuten eine Herausforderung darstellt. CYB003 könnte das Potenzial haben, diese Herausforderungen zu bewältigen, und mit der Breakthrough Therapy Designation der FDA wird der regulatorische Weg nach vorne beschleunigt", sagte Dr. Maurizio Fava, M.D., Vorsitzender der Abteilung für Psychiatrie und Chefarzt der Psychiatrie am Massachusetts General Hospital.
Positive Vier-Monats-Wirksamkeitsdaten für CYB003
-
Robuste und anhaltende Verbesserungen der Depressionssymptome mit zwei Dosen von 12 mg oder 16 mg CYB003:
- Die mittlere Reduktion des MADRS-Gesamtscores betrug in beiden Dosierungskohorten etwa 22 Punkte gegenüber dem Ausgangswert.
- Ungefähr 75% der Patienten waren Responder (>/= 50% Verbesserung der MADRS-Scores) nach zwei Dosen von 16 mg.
- Bei 60 % der Patienten, die 12 mg erhielten, und 75 % der Patienten, die 16 mg erhielten, war die Depression nach 2 Dosen in Remission (MADRS-Score </= 10).
Sicherheit und Verträglichkeit:
- CYB003 wurde gut vertragen, und es traten keine schwerwiegenden unerwünschten Ereignisse im Zusammenhang mit dem Medikament auf.
- Alle unerwünschten Ereignisse waren von leichter oder mittlerer Intensität.
- Es gab keine Vorfälle von Selbstmordgedanken oder -verhalten.
- Keine Abbrüche aufgrund von unerwünschten Ereignissen.
"Die anhaltende Verringerung der Depressionssymptome an der Vier-Monats-Marke nach nur zwei CYB003-Dosen ist ein entscheidender Meilenstein, der die Dauerhaftigkeit der Reaktion nach der raschen Verbesserung der Symptome zeigt. Er ebnet auch den Weg für einen Paradigmenwechsel in der Behandlung von MDD. Im Gegensatz zu den derzeit zugelassenen Begleittherapien, die eine chronische, tägliche Einnahme erfordern, ermöglicht CYB003 eine intermittierende Einnahme, ohne dass die Patienten von ihren bestehenden Medikamenten abgesetzt werden müssen", erklärte Amir Inamdar, MBBS, DNB (Psych), MFPM, Medizinischer Leiter von Cybin. "Die Daten zur Dauerhaftigkeit zeigten, dass nach vier Monaten etwa 75 % der Patienten auf die Behandlung ansprachen, was bedeutet, dass sie eine Verbesserung ihrer MADRS-Werte um 50 % oder mehr erreichten. Bei beiden Dosierungen konnten wir außerdem beobachten, dass nach vier Monaten 60 % der Patienten, die 12 mg erhielten, und 75 % der Patienten, die 16 mg erhielten, einen MADRS-Wert von 10 oder weniger erreichten, was bedeutet, dass sie sich in Remission befanden und keine Anzeichen einer Depression mehr zeigten. Angesichts dieser positiven Ergebnisse sind wir bestrebt, das Programm voranzutreiben und den Millionen von Menschen, die davon profitieren könnten, Erleichterung und Behandlungsalternativen zu bieten", schloss Inamdar.
"Es ist wirklich bemerkenswert, dass die Teilnehmer nach vier Monaten eine anhaltende Verringerung und zunehmende Verbesserung der Depressionssymptome erfahren haben", so Drysdale weiter. "Beeindruckend ist, dass die durchschnittliche Verringerung des MADRS-Gesamtergebnisses gegenüber dem Ausgangswert nach vier Monaten etwa 22 Punkte betrug (im Vergleich zu einer durchschnittlichen Verringerung von 14 Punkten gegenüber Placebo und 17 Punkten gegenüber dem Ausgangswert nach drei Wochen). Dies ist sehr ermutigend, insbesondere für Patienten, die auf bestehende Behandlungsmöglichkeiten nicht angesprochen haben. Wir freuen uns auf den Beginn unserer Phase-3-Studie, bei der wir davon ausgehen, dass es sich um eine internationale, standortübergreifende Studie handeln wird, um die Sicherheit und Wirksamkeit von CYB003-Kapseln in einer grösseren MDD-Patientengruppe weiter zu untersuchen. Wir sind stolz darauf, mit diesem Programm eine Vorreiterrolle einzunehmen und zur wachsenden Zahl wissenschaftlicher Erkenntnisse beizutragen, die das therapeutische Potenzial psychedelischer Drogen zur Behandlung einer Vielzahl psychischer Störungen belegen", so Drysdale abschließend.
Der MADRS ist eine 10 Punkte umfassende Skala, die von Ärzten zur Messung des Gesamtschweregrads der depressiven Symptome bei Patienten mit MDD eingesetzt wird. Sie wird häufig in klinischen Studien eingesetzt und von den Zulassungsbehörden weltweit als Maß für die Symptome der Depression akzeptiert. Die MADRS umfasst Punkte, die von trauriger Stimmung, Schlaf- und Appetitminderung bis hin zu Konzentrationsschwierigkeiten, Anhedonie sowie negativen und suizidalen Gedanken reichen und mit Werten von 0 bis 6 bewertet werden, so dass sich ein Gesamtwert von 0 bis 60 ergibt. Typische Wertebereiche für den Schweregrad sind: 0-6 normal; 7-19 leicht; 20-34 mittelschwer; und >34 schwere Depression. In der CYB003-Studie betrugen die mittleren Ausgangswerte des MADRS 31,4 bis 33,7 in der aktiven Gruppe und 30,8 in der Placebogruppe.
Erheblicher ungedeckter medizinischer Bedarf bei Depressionen
Depressionen sind die häufigste Ursache für Behinderungen aufgrund psychischer Erkrankungen2 und betreffen weltweit über 300 Millionen Menschen. 3 Trotz des Einsatzes derzeit verfügbarer Therapien wie selektiver Serotonin-Wiederaufnahmehemmer ("SSRI") erreichen bis zu zwei Drittel der Patienten mit Depressionen keine Remission mit einer ersten antidepressiven Behandlung.4 Mehr als 43 Millionen Amerikaner nehmen Antidepressiva ein, und über 70 % dieser Personen werden mit SSRI behandelt.5 Die BTD von CYB003 als Zusatztherapie für MDD unterstreicht die dringende Notwendigkeit, diese Behandlungslücke zu schließen, da ein erheblicher Anteil der Patienten mit den bestehenden Therapien keine Linderung erfährt.
Einzelheiten zur Telefonkonferenz und zum Webcast:
Datum: Mittwoch, 13. März 2024
Uhrzeit 8:30 ET.
Einwahl: 800-267-6316 (U.S. gebührenfrei) oder 203-518-9783 (International)
Konferenz-ID: CYBN0313
Webcast: Registrieren Sie sich für den Webcast hier
Der archivierte Webcast wird auch auf der Investor Relations-Website des Unternehmens auf der Seite Events & Präsentationen verfügbar sein.
Anmerkungen:
- Stone et al. (2022) Response to acute monotherapy for major depressive disorder in randomized, placebo-controlled trials submitted to the US Food and Drug Administration: individual participant data analysis. BMJ (Clinical research ed.) , 378, e067606.
- GBD 2019 Diseases and Injuries Collaborators (2020). Global burden of 369 diseases and injuries in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet 396: 1204–22.
- Friedrich M. J. (2017). Depression Is the Leading Cause of Disability Around the World. JAMA , 317(15), 1517. https://doi.org/10.1001/jama.2017.3826 .
- Rush et al. Am J Psychiatry 2006; 163:1905–1917.
- Sood et al. (2023). Selective serotonin reuptake inhibitor use, age-related neuropathology and cognition in late-life. Psychiatry Research 328.
- Es gibt keine Garantie, dass die Fristen eingehalten werden. Die voraussichtlichen Zeitpläne für die Medikamentenentwicklung beruhen auf vernünftigen Annahmen, die auf dem aktuellen Wissensstand und den dem Unternehmen zur Verfügung stehenden Informationen basieren. Diese Aussagen beruhen unter anderem auf den behördlichen Richtlinien für die Entwicklung eines Medikaments mit Sicherheitsstudien, Proof-of-Concept-Studien und entscheidenden Studien für die Einreichung und Zulassung eines neuen Medikaments und gehen von der erfolgreichen Durchführung und den Ergebnissen solcher Studien innerhalb der Zeiträume aus, die nach diesen Richtlinien, anderen Branchenbeispielen und den bisherigen Entwicklungsbemühungen des Unternehmens möglich sind.
Über Cybin
Cybin ist ein Biopharma-Unternehmen, das in der klinischen Phase tätig ist und sich zum Ziel gesetzt hat, sichere und wirksame Therapeutika auf psychedelischer Basis zu entwickeln, die den großen ungedeckten Bedarf an neuen und innovativen Behandlungsmöglichkeiten für Menschen, die unter psychischen Erkrankungen leiden, decken.
Cybins Ziel, die psychische Gesundheitspflege zu revolutionieren, wird durch ein Netzwerk von Weltklasse-Partnern und international anerkannten Wissenschaftlern unterstützt, die darauf abzielen, eigene Wirkstoffforschungsplattformen, innovative Wirkstoffverabreichungssysteme sowie neuartige Formulierungsansätze und Behandlungsverfahren voranzutreiben. Das Unternehmen entwickelt derzeit CYB003, ein proprietäres deuteriertes Psilocybin-Analogon zur Behandlung von MDD, und CYB004, ein proprietäres deuteriertes DMT-Molekül zur Behandlung der generalisierten Angststörung, und verfügt über eine Forschungspipeline mit psychedelischen Wirkstoffen.
Cybin hat seinen Hauptsitz in Kanada und wurde 2019 gegründet. Das Unternehmen ist in Kanada, den Vereinigten Staaten, dem Vereinigten Königreich, den Niederlanden und Irland tätig. Für Unternehmens-Updates und um mehr über Cybin zu erfahren, besuchen Sie www.cybin.com oder folgen Sie dem Team auf X, LinkedIn, YouTube and Instagram.
Sicherheitshinweise und zukunftsgerichtete Aussagen
Bestimmte Aussagen in dieser Pressemitteilung, die sich auf das Unternehmen beziehen, sind zukunftsgerichtete Aussagen und haben einen prospektiven Charakter. Zukunftsgerichtete Aussagen beruhen nicht auf historischen Fakten, sondern auf aktuellen Erwartungen und Prognosen über zukünftige Ereignisse und unterliegen daher Risiken und Unsicherheiten, die dazu führen können, dass die tatsächlichen Ergebnisse erheblich von den in den zukunftsgerichteten Aussagen ausgedrückten oder implizierten Ergebnissen abweichen. Diese Aussagen sind im Allgemeinen an der Verwendung von zukunftsgerichteten Wörtern wie "können", "sollten", "könnten", "beabsichtigen", "schätzen", "planen", "antizipieren", "erwarten", "glauben" oder "fortsetzen" bzw. deren Verneinung oder ähnlichen Varianten zu erkennen. Zukunftsgerichtete Aussagen in dieser Pressemitteilung beinhalten Aussagen über die geplanten klinischen Studien des Unternehmens und die Pläne zur Beschleunigung der Herstellungs- und Entwicklungsstrategie für CYB003; das Potenzial von CYB003, eine signifikante Verbesserung gegenüber bestehenden Therapien zu bieten; den Fortschritt von CYB003 in Richtung einer Phase-3-Studie Mitte 2024; die potenzielle Verkürzung der Zeiträume für die Medikamentenentwicklung, die durch die BTD ermöglicht wird; und die Pläne des Unternehmens, proprietäre Plattformen für die Entdeckung von Medikamenten, innovative Systeme für die Verabreichung von Medikamenten, neuartige Formulierungsansätze und Behandlungsregime für psychische Erkrankungen zu entwickeln.
Diese zukunftsgerichteten Aussagen beruhen auf begründeten Annahmen und Schätzungen des Managements des Unternehmens zu dem Zeitpunkt, als diese Aussagen gemacht wurden. Die tatsächlichen zukünftigen Ergebnisse können erheblich abweichen, da zukunftsgerichtete Aussagen bekannte und unbekannte Risiken, Ungewissheiten und andere Faktoren beinhalten, die dazu führen können, dass die tatsächlichen Ergebnisse, Leistungen oder Errungenschaften des Unternehmens erheblich von den zukünftigen Ergebnissen, Leistungen oder Errungenschaften abweichen, die in solchen zukunftsgerichteten Aussagen ausgedrückt oder impliziert werden. Zu diesen Faktoren gehören unter anderem: Auswirkungen der Verbreitung von COVID-19 auf die Geschäftstätigkeit des Unternehmens; Schwankungen der allgemeinen makroökonomischen Bedingungen; Schwankungen der Wertpapiermärkte; Erwartungen hinsichtlich der Größe des Psychedelika-Marktes; die Fähigkeit des Unternehmens, seine Geschäftsziele erfolgreich zu erreichen; Wachstumspläne; politische, soziale und umweltbezogene Unwägbarkeiten; Mitarbeiterbeziehungen; das Vorhandensein von Gesetzen und Vorschriften, die in den Märkten, in denen das Unternehmen tätig ist, Beschränkungen auferlegen können; und die Risikofaktoren, die im Bericht der Geschäftsleitung des Unternehmens für den Drei- und Neunmonatszeitraum bis zum 31. Dezember 2023 und im Jahresbericht des Unternehmens für das Jahr bis zum 31. März 2023 dargelegt sind, die unter dem Profil des Unternehmens auf www.sedarplus.com und bei der U.S. Securities and Exchange Commission auf EDGAR unter www.sec.gov verfügbar sind. Obwohl die in dieser Pressemitteilung enthaltenen zukunftsgerichteten Aussagen auf Annahmen beruhen, die das Management des Unternehmens für vernünftig hält oder zu diesem Zeitpunkt für vernünftig hielt, kann das Unternehmen den Aktionären nicht versichern, dass die tatsächlichen Ergebnisse mit diesen zukunftsgerichteten Aussagen übereinstimmen werden, da es andere Faktoren geben kann, die dazu führen, dass die Ergebnisse nicht so ausfallen wie erwartet, geschätzt oder beabsichtigt. Die Leser sollten sich nicht in unangemessener Weise auf die in dieser Pressemitteilung enthaltenen zukunftsgerichteten Aussagen und Informationen verlassen. Das Unternehmen übernimmt keine Verpflichtung, die zukunftsgerichteten Aussagen über Überzeugungen, Meinungen, Prognosen oder andere Faktoren zu aktualisieren, sollten sich diese ändern, es sei denn, dies ist gesetzlich vorgeschrieben.
Cybin erhebt keine Ansprüche auf medizinische, therapeutische oder gesundheitliche Vorteile der von Cybin vorgeschlagenen Produkte. Die FDA, die kanadische Gesundheitsbehörde oder andere ähnliche Regulierungsbehörden haben Behauptungen über Psilocybin, psychedelische Tryptamine, Tryptaminderivate oder andere psychedelische Verbindungen nicht bewertet. Die Wirksamkeit solcher Produkte ist nicht durch anerkannte Forschungsarbeiten bestätigt worden. Es gibt keine Garantie dafür, dass die Verwendung von Psilocybin, psychedelischen Tryptaminen, Tryptaminderivaten oder anderen psychedelischen Verbindungen Krankheiten oder Zustände diagnostizieren, behandeln, heilen oder verhindern kann. Strenge wissenschaftliche Forschung und klinische Studien sind erforderlich. Cybin hat keine klinischen Studien für die Verwendung der von ihr vorgeschlagenen Produkte durchgeführt. Alle Hinweise auf Qualität, Konsistenz, Wirksamkeit und Sicherheit potenzieller Produkte bedeuten nicht, dass Cybin diese in klinischen Versuchen überprüft hat oder dass Cybin solche Versuche abschließen wird. Sollte Cybin nicht in der Lage sein, die für die Kommerzialisierung seines Geschäfts erforderlichen Genehmigungen oder Forschungsarbeiten zu erhalten, kann dies erhebliche negative Auswirkungen auf die Leistung und den Betrieb von Cybin haben.
Weder die Cboe Canada noch die Börse NYSE American LLC haben den Inhalt dieser Pressemitteilung genehmigt oder abgelehnt und sind nicht verantwortlich für die Angemessenheit und Richtigkeit des Inhalts dieser Mitteilung.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.