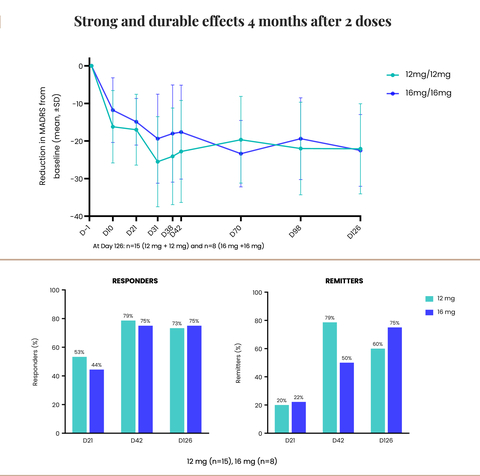
TORONTO--(BUSINESS WIRE)--Cybin Inc. (NYSE American:CYBN) (Cboe CA:CYBN) ("Cybin" o l'"Azienda"), un'azienda biofarmaceutica di ambito clinico che si dedica a rivoluzionare la salute mentale sviluppando nuove opzioni di trattamento innovative a base di sostanze psichedeliche di prossima generazione, ha annunciato oggi che la FDA ha concesso la denominazione BTD a CYB003, l'analogo deuterato della psilocibina di sua proprietà in sviluppo per la terapia aggiuntiva dell'MDD.
Il testo originale del presente annuncio, redatto nella lingua di partenza, è la versione ufficiale che fa fede. Le traduzioni sono offerte unicamente per comodità del lettore e devono rinviare al testo in lingua originale, che è l'unico giuridicamente valido.