Cybin recibe la designación de terapia innovadora de la FDA para su nueva molécula psicodélica CYB003 y anuncia resultados positivos durante cuatro meses en el trastorno depresivo mayor
Cybin recibe la designación de terapia innovadora de la FDA para su nueva molécula psicodélica CYB003 y anuncia resultados positivos durante cuatro meses en el trastorno depresivo mayor
- La designación de terapia innovadora (BTD, por sus siglas en inglés) ofrece una vía de revisión más rápida, así como un mayor acceso a las recomendaciones de la Administración de Alimentos y Medicamentos de EE.UU. (FDA, por sus siglas en inglés) sobre el diseño de los ensayos, lo que puede reducir significativamente los plazos de desarrollo de los medicamentos -
- Es la primera BTD concedida por la FDA a una terapia complementaria que utiliza psicodélicos para el tratamiento del trastorno depresivo mayor (MDD, por sus siglas en inglés) -
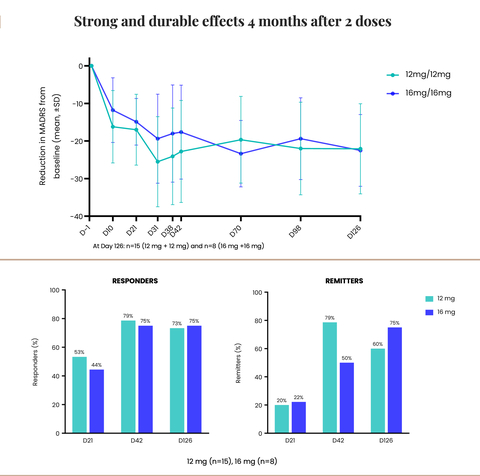
- Mejora sustancial, duradera y estadísticamente significativa de los síntomas de la depresión a los cuatro meses, con un 75 % de pacientes en remisión de la depresión tras dos dosis (16 mg) -
- Reducción media impresionante de 22 puntos en la puntuación de la Escala de calificación de la depresión de Montgomery-Asberg (MADRS, por sus siglas en inglés) desde el inicio hasta los cuatro meses -
- Los datos apoyan la progresión hacia un estudio multinacional pivotal de fase 3 de CYB003 para el MDD a mediados de 2024 -
- La consecución de los objetivos agiliza y reduce los riesgos del programa de desarrollo de CYB003 -
- La empresa ofrecerá hoy a las 8:30 h ET un webcast para comentar las novedades del programa CYB003 -
Esta noticia se considera una «comunicación de prensa designada» a efectos de los suplementos de prospecto de Cybin, cada uno de ellos de fecha 23 de agosto de 2023, en relación con su prospecto básico abreviado de fecha 17 de agosto de 2023, modificado el 22 de diciembre de 2023.
TORONTO--(BUSINESS WIRE)--Cybin Inc. (NYSE American:CYBN) (Cboe CA:CYBN) («Cybin» o la «Empresa»), una empresa biofarmacéutica en fase clínica comprometida a revolucionar la atención sanitaria mental mediante el desarrollo de nuevas e innovadoras opciones de tratamiento basadas en psicodélicos de nueva generación, ha anunciado hoy que la FDA ha concedido la BTD a CYB003, su análogo de psilocibina deuterada patentado en desarrollo para el tratamiento adyuvante del MDD.
El comunicado en el idioma original es la versión oficial y autorizada del mismo. Esta traducción es solamente un medio de ayuda y deberá ser comparada con el texto en idioma original, que es la única versión del texto que tendrá validez legal.
Contacts
Inversores y medios de comunicación:
Gabriel Fahel
Director jurídico
Cybin Inc.
1-866-292-4601
irteam@cybin.com – o – media@cybin.com