DANVERS, Massachusetts--(BUSINESS WIRE)--Abiomed (NASDAQ: ABMD) gibt bekannt, dass die US-amerikanische Arzneimittelbehörde (FDA) den Antrag des Unternehmens auf Ausnahmegenehmigung für Prüfpräparate bewilligt hat, um eine frühe Machbarkeitsstudie mit einer ersten Studie am Menschen mit der Herzpumpe Impella ECP™ mit einem Außendurchmesser von 9 Charrière (CH) zu beginnen. Impella ECP, was für Expandable Cardiac Power (dt. expandierbare Herzleistung) steht, wurde in Deutschland entwickelt und soll bei Hochrisikopatienten mit perkutaner Koronarintervention (PCI) untersucht werden.
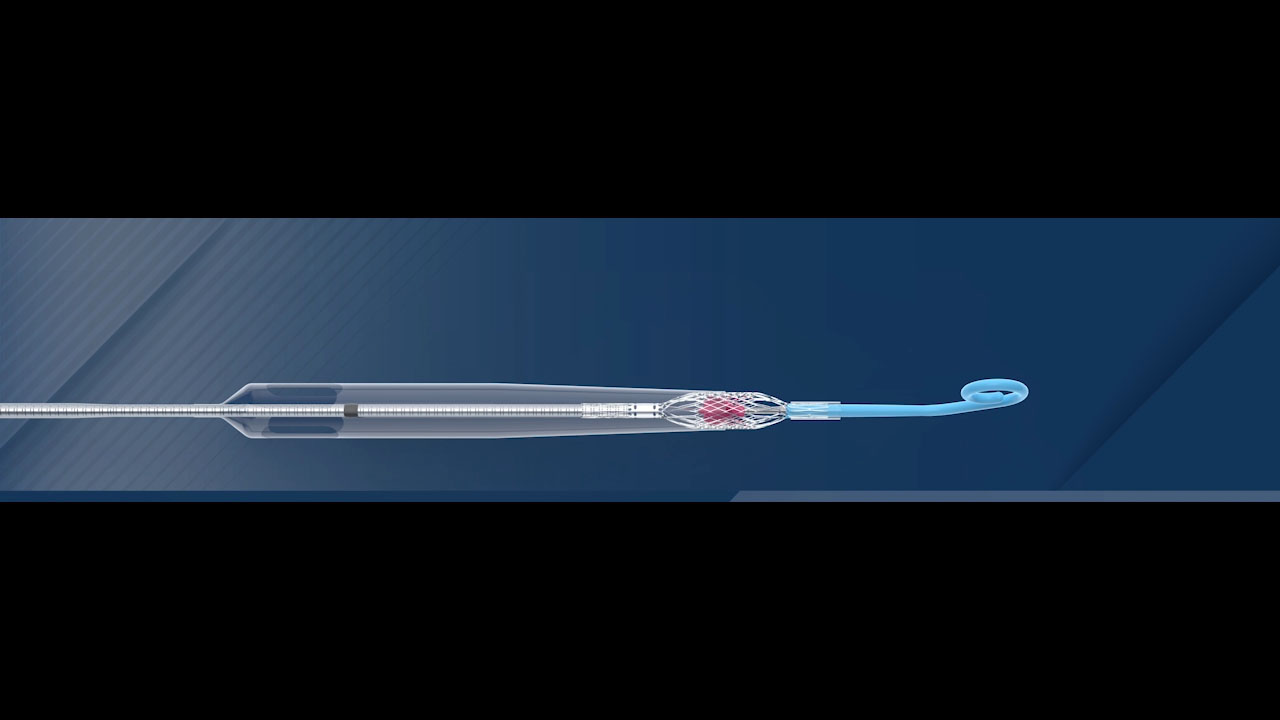
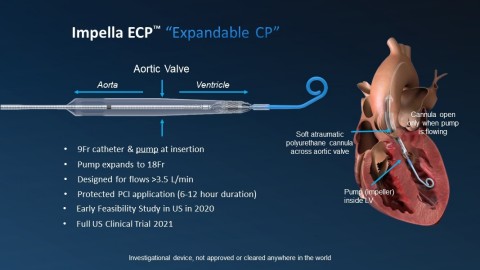
Impella ECP ist die kleinste Herzpumpe der Welt. Sie erreicht Spitzenvolumenströme von mehr als 3,5 l/min und wird durch einen Schaft mit schlankem Profil eingeführt. Sie wird in der absteigenden Aorta nicht ummantelt und dehnt sich auf etwa 18 CH. aus. Mit einem speziell entwickelten Pigtail durchquert sie die Aortenklappe drahtlos und pumpt aus dem Inneren des Ventrikels. Wenn das Verfahren abgeschlossen ist, wird die Pumpe wieder auf 9 CH verkleinert und mit demselben Profil entfernt.
Ein einzigartiges Konstruktionsmerkmal von Impella ECP ist, dass es mit einer weichen, atraumatischen Polyurethankanüle, die sich nur öffnet, wenn die Pumpe fließt, über dem Ventil sitzt. Wenn die Pumpe aus irgendeinem Grund stoppt, entspannt sich diese Kanüle, sodass sich die Ventilsegmente um sie herum schließen können, wodurch die Ventilkompetenz erhalten bleibt. Impella ECP ist für die kurzfristige mechanische Unterstützung bei Patienten mit einer Hochrisiko-PCI vorgesehen, um sowohl den Kreislauf zu unterstützen als auch die linksventrikuläre Entlastung zu gewährleisten.
Für interventionelle Kardiologen sind der Gefäßzugang und -verschluss entscheidend für den Erfolg von PCI-Verfahren mit mechanischer Kreislaufunterstützung. Typischerweise müssen bei diesen Verfahren zur Durchführung des Eingriffs Hülsen oder Kanülen im Bereich von 13-24 CH platziert werden. Die Impella ECP ermöglicht eine kleinere Zugangsstelle, was die Akzeptanz erhöhen kann.
„Wir sind von den Vorteilen dieser neuen bahnbrechenden Technologie, die den Bereich der Wiederherstellung der Herzfunktion voranbringt, begeistert“, sagte Michael R. Minogue, Abiomeds Chairman, President und Chief Executive Officer. „Abiomed tätigt bedeutende Investitionen, um kleinere, intelligentere und besser vernetzte Technologien zu entwickeln, welche die Grundlage für die anhaltende Führungsposition des Unternehmens auf dem Gebiet der mechanischen Kreislaufunterstützung bilden.“
Die prospektive, multizentrische, nicht-randomisierte frühe Machbarkeitsstudie wird es Abiomed, den Prüfärzten der Studie und der FDA ermöglichen, qualitative Beurteilungen über die Sicherheit und Machbarkeit der Anwendung von Impella ECP bei Hochrisikopatienten zu treffen. Der primäre Endpunkt der Studie ist die erfolgreiche Durchführung, Initiierung und Aufrechterhaltung einer adäquaten hämodynamischen Unterstützung und eine zusammengesetzte Quote wichtiger gerätebedingter unerwünschter Ereignisse während einer Hochrisiko-PCI. Das Studienprotokoll sieht die Aufnahme und Behandlung von bis zu fünf US-Patienten vor, die eine Revaskularisierung benötigen. Bei Erfolg wird die Rekrutierung auf weitere Patienten ausgeweitet, sofern die Genehmigung der FDA vorliegt. Die Prüfärzte werden noch in diesem Kalenderjahr mit der Patientenrekrutierung für die erste am Menschen durchgeführte Studie beginnen.
Impella ECP ist nur für die Verwendung in Studien verfügbar und nicht für die Verwendung außerhalb von klinischen Studien zugelassen.
ÜBER IMPELLA-HERZPUMPEN
Die Geräte Impella 2.5® und Impella CP® haben die PMA-Zulassung der FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen erhalten, die sich einer elektiven und dringlichen perkutanen Koronarintervention (PCI), wie etwa einer Stentimplantation oder Ballonangioplastie, unterziehen, um verstopfte Koronararterien freizumachen. Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5™ mit Smart Assist® sind von der FDA zugelassene Herzpumpen zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können. Impella RP® ist von der FDA zur Behandlung von Rechtsherzinsuffizienz oder Dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, einem Myokardinfarkt, einer Herztransplantation oder einer Operation am offenen Herzen zugelassen. Das Impella-RP-System darf außerdem im Rahmen eines Notfalleinsatzes von medizinischem Fachpersonal im Krankenhaus zur vorübergehenden rechtsventrikulären Unterstützung für die Dauer von bis zu 14 Tagen bei Intensivpatienten mit einer Körperoberfläche von ≥ 1,5 m2 zur Behandlung einer akuten Rechtsherzinsuffizienz oder -dekompensation aufgrund von Komplikationen im Zusammenhang mit der Coronavirus-Erkrankung 2019 (COVID-19), einschließlich Lungenembolie (PE), eingesetzt werden. Die Impella-RP ist weder für die Behandlung der akuten Rechtsherzinsuffizienz noch für die Behandlung der Dekompensation aufgrund von Komplikationen im Zusammenhang mit COVID-19 freigegeben oder zugelassen. Die Impella RP wurde von der FDA im Rahmen einer EUA für einen oben bezeichneten Notfalleinsatz nur für die Dauer der Erklärung, dass Umstände vorliegen, die die Notfallgenehmigung medizinischer Geräte gemäß Abschnitt 564(b)(1) von Act. 21 U.S.C. § 360bbb-3(b)(1) begründen, zugelassen, es sei denn, die Zulassung wird früher beendet oder widerrufen.
In Europa sind Impella 2.5, Impella CP und Impella CP mit SmartAssist für eine bis zu fünftägige Behandlung von Hochrisiko-PCI- und AMI-Patienten mit kardiogenem Schock CE-zertifiziert. Impella 5.0 und Impella LD sind CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten bei kardiogenem Schock bis zu 10 Tage lang zu behandeln. Die Impella 5.5™ mit Smart Assist® ist CE-gekennzeichnet, um Herzinfarkt- oder Kardiomyopathie-Patienten bei kardiogenem Schock bis zu 30 Tage lang zu behandeln. Die Impella RP ist CE-gekennzeichnet, um Rechtsherzversagen oder -dekompensation nach Implantation des linksventrikulären Unterstützungssystems, Myokardinfarkt, Herztransplantation, Operation am offenen Herzen oder refraktärer ventrikulärer Arrhythmie zu behandeln.
Nähere Informationen über die Impella-Herzpumpenplattform, einschließlich der zugelassenen Indikationen und wichtiger Sicherheits- und Risikoinformationen zur Anwendung der Geräte, finden Sie unter www.impella.com.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung. Unsere Produkte sollen durch die Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens die Erholung des Herzens ermöglichen. Weitere Informationen finden Sie unter www.abiomed.com.
Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist und Impella Connect sind eingetragene Marken von Abiomed, Inc. und in den USA und bestimmten anderen Ländern eingetragen. Impella BTR, Impella ECP, CVAD Study und STEMI DTU Study sind angemeldete Marken von Abiomed, Inc.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter auch in Bezug auf die Entwicklung bereits bestehender und neuer Produkte von Abiomed, das kommerzielle Wachstum des Unternehmens, zukünftige Geschäftsmöglichkeiten und ausstehende regulatorische Genehmigungen. Die tatsächlichen Ergebnisse des Unternehmens können sich aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen erwarteten Ergebnissen unterscheiden, darunter Unwägbarkeiten im Zusammenhang mit Umfang, Ausmaß und Dauer der Auswirkungen der COVID-19-Pandemie, mit der Entwicklung, Prüfung und damit verbundenen regulatorischen Genehmigungen, einschließlich der Möglichkeit künftiger Verluste, mit komplexer Herstellung, hohen Qualitätsanforderungen, Abhängigkeit von begrenzten Bezugsquellen, Wettbewerb, technologischen Veränderungen, staatlichen Auflagen, Rechtsstreitigkeiten, künftigem Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie anderen Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission (SEC) hinterlegten Unterlagen des Unternehmens, einschließlich des neuesten Jahresberichts auf Formblatt 10-K und der nachfolgend bei der SEC eingereichten Unterlagen. Den Lesern dieser Pressemitteilung wird geraten, zukunftsgerichtete Aussagen, die ausschließlich den Informationsstand am Tag der Veröffentlichung widerspiegeln, nicht als verlässliche Informationen zu bewerten. Das Unternehmen ist nicht dazu verpflichtet, Aktualisierungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, die Ereignisse oder Umstände widerspiegeln, die nach dem Zeitpunkt der Veröffentlichung eintreten oder durch die Einwirkung unvorhersehbarer Ereignisse zustande kommen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.