DANVERS, Massachusetts--(BUSINESS WIRE)--Abiomed (NASDAQ: ABMD) annonce que l'Agence américaine des produits alimentaires et médicamenteux (FDA) a approuvé sa demande dérogatoire de dispositif expérimental en vue de démarrer une étude de faisabilité préparatoire avec un premier essai sur l'homme de la pompe cardiaque Impella ECP™ à 9 Charrière (Ch). L'Impella ECP (pour Expandable Cardiac Power) sera étudiée chez des patients subissant une intervention coronarienne percutanée (ICP) à haut risque.
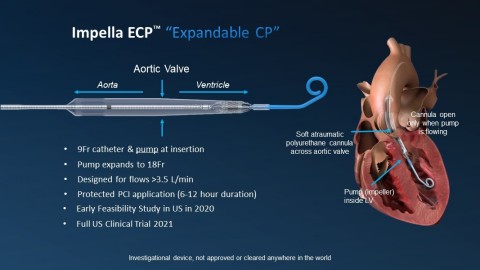
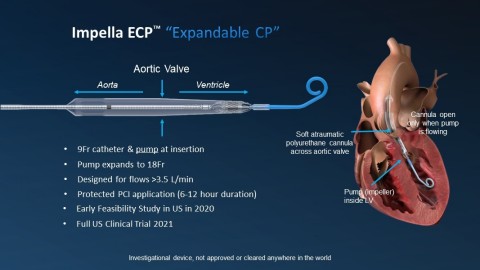
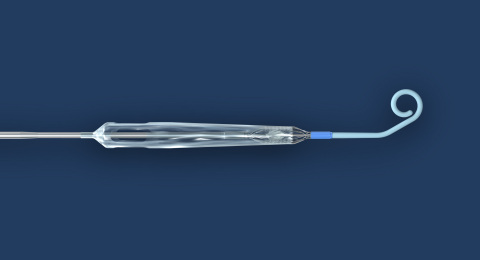
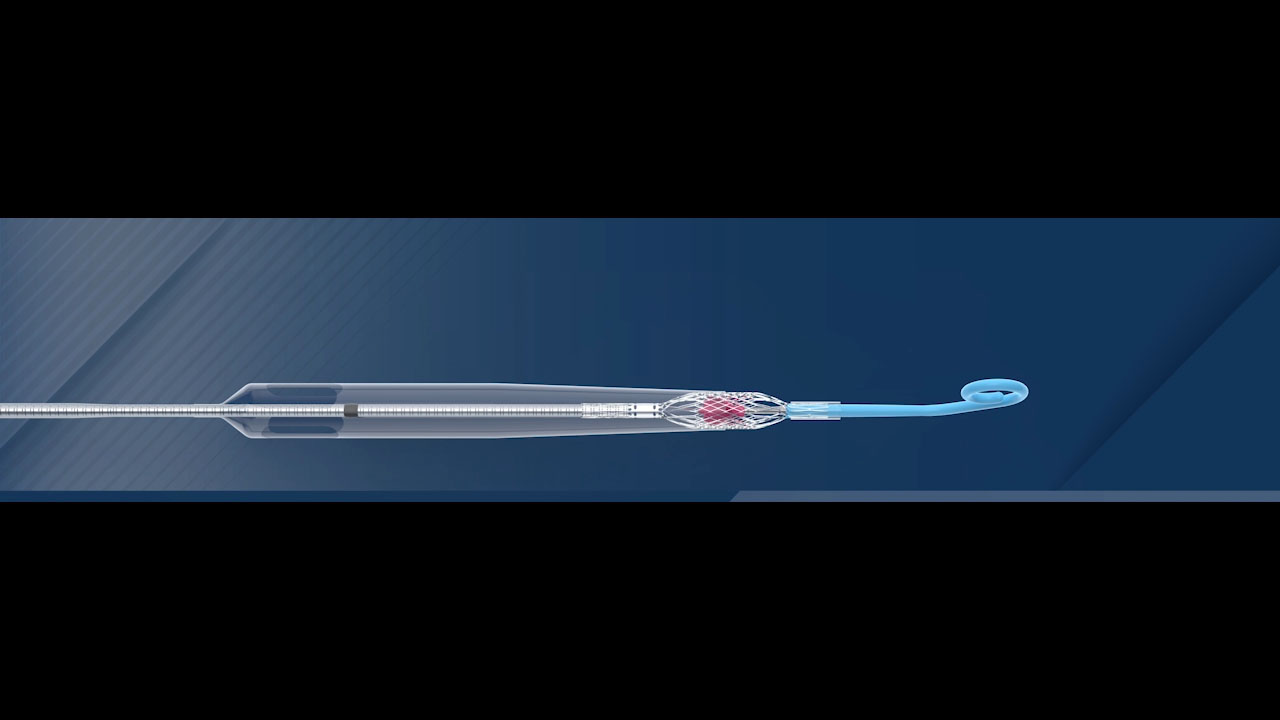
L'Impella ECP est la plus petite pompe cardiaque au monde. Elle atteint des débits de pointe supérieurs à 3,5 L/min et se pose à l'aide d'une gaine profilée. Elle est dégainée dans l'aorte descendante et se déploie jusqu'à environ 18 Fr. À l'aide d'un embout court spécialement conçu, elle traverse la valve aortique sans un fil, et pompe depuis l'intérieur du ventricule. Une fois l'intervention terminée, la pompe est rengainée à un diamètre de 9 Ch, puis retirée avec le même profil.
Une caractéristique unique de l'Impella ECP est qu'elle repose sur la valve avec une canule en polyuréthane atraumatique souple qui s'ouvre uniquement lorsque la pompe s'écoule. Quelle que soit la raison, si la pompe s'arrête, cette canule se détend pour permettre aux valvules de se refermer autour, maintenant ainsi la fonction de la valve. L'Impella ECP est destinée à une assistance mécanique à court terme pour des patients subissant une ICP à haut risque, afin de fournir une assistance circulatoire et une décharge ventriculaire gauche.
Pour les cardiologues interventionnels, l'accès vasculaire et la fermeture sont des éléments essentiels dans la réussite des ICP avec assistance circulatoire mécanique. Habituellement, ces interventions nécessitent la pose de gaines ou de canules allant de 13 à 24 Ch. L'Impella ECP permet d'avoir un site d'accès plus petit, ce qui pourrait promouvoir son adoption.
"Nous sommes très satisfaits des avantages que procurent cette nouvelle technologie révolutionnaire, qui fait progresser le domaine du rétablissement en cardiologie", déclare Michael R. Minogue, président du conseil et PDG d'Abiomed. "Abiomed réalise d'importants investissements pour mettre au point une technologie plus compacte, intelligente et connectée, sur laquelle repose son leadership renouvelé dans le domaine de l'assistance circulatoire mécanique."
L'étude de faisabilité préparatoire prospective, multicentrique et non randomisée permettra à Abiomed, aux chercheurs et à la FDA de faire des évaluations qualitatives de l'innocuité et de la faisabilité de l'utilisation de l'Impella ECP sur des patients à haut risque. Le critère principal de l'étude est la réussite de la pose, du lancement et du maintien d'une assistance hémodynamique adaptée, et un taux mixte d'événements indésirables majeurs liés au dispositif durant une ICP à haut risque. Le protocole d'étude recrutera et traitera jusqu'à cinq patients américains nécessitant une revascularisation. En cas de succès, des patients supplémentaires seront recrutés, sous réserve d'approbation de la FDA. Les chercheurs de l'étude débuteront le recrutement des patients plus tard dans l'année pour le premier essai sur l'homme.
L'Impella ECP est uniquement disponible pour une utilisation expérimentale et n'est pas approuvée pour une utilisation en dehors d'études cliniques.
À PROPOS DES POMPES CARDIAQUES IMPELLA
L'Impella 2.5® et l'Impella CP® ont reçu une autorisation préalable de mise sur le marché (PMA) de la FDA américaine pour traiter certains patients souffrant d'insuffisance cardiaque avancée et subissant des interventions coronariennes percutanées (ICP) urgentes et non urgentes, telles que la pose de stents ou l'angioplastie par ballonnet, afin de rouvrir des artères coronaires obstruées. L'Impella 2.5, l'Impella CP, l'Impella CP avec SmartAssist®, l'Impella 5.0®, l'Impella LD®, et l'Impella 5.5™ avec Smart Assist® sont des pompes cardiaques approuvées par la FDA américaine, utilisées pour traiter les patients victimes d'une crise cardiaque ou d'une cardiomyopathie en état de choc cardiogénique. Elles ont la capacité unique de permettre la récupération du cœur natif, ce qui permet aux patients de rentrer chez eux avec leur propre cœur. L'Impella RP® est approuvée par la FDA américaine pour traiter l'insuffisance cardiaque droite ou la décompensation suite à l'implantation d'un dispositif d'assistance ventriculaire gauche, l'infarctus du myocarde, la transplantation cardiaque, la chirurgie à cœur ouvert. L'Impella RP est également approuvée pour une utilisation en urgence par du personnel soignant en milieu hospitalier afin de fournir un soutien ventriculaire droit temporaire pour une période allant jusqu'à 14 jours chez des patients en soins intensifs ayant une surface corporelle ≥ 1,5 m2, pour le traitement de l'insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées au coronavirus 2019 (COVID-19), y compris l'embolie pulmonaire (EP). L'Impella RP n'a été ni autorisée ni approuvée pour le traitement de l'insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées au COVID-19. L'Impella RP a été autorisé pour l'utilisation d'urgence susmentionnée par la FDA en vertu d'une EUA et a été autorisé uniquement pour la durée de la déclaration de l'existence de circonstances justifiant l'autorisation de l'utilisation d'urgence de dispositifs médicaux en vertu de la section 564(b)(1) de la loi, 21 U.S.C. § 360bbb-3(b)(1), à moins que l'autorisation ne soit résiliée ou révoquée plus tôt.
En Europe, l'Impella 2.5, l'Impella CP et l'Impella CP avec SmartAssist sont marquées CE pour le traitement des patients à haut risque de choc cardiogénique par ICP et IAM pendant une période allant jusqu'à 5 jours. L'Impella 5.0 et l'Impella LD sont marquées CE pour le traitement des patients victimes d'une crise cardiaque ou d'une cardiomyopathie en état de choc cardiogénique pendant une période allant jusqu'à 10 jours. L'Impella 5.5™ avec Smart Assist® est marquée CE pour traiter les patients victimes d'une crise cardiaque ou d'une cardiomyopathie en état de choc cardiogénique pendant une période allant jusqu'à 30 jours. L'Impella RP est marquée CE pour traiter l'insuffisance cardiaque droite ou la décompensation suite à l'implantation d'un dispositif d'assistance ventriculaire gauche, l'infarctus du myocarde, la transplantation cardiaque, la chirurgie à cœur ouvert ou l'arythmie ventriculaire réfractaire.
Pour en savoir plus sur la plateforme de pompes cardiaques Impella, y compris leurs indications approuvées et les informations importantes sur la sécurité et les risques associés à l'utilisation des dispositifs, veuillez consulter le site www.impella.com.
À PROPOS D'ABIOMED
Basé à Danvers, dans le Massachusetts, États-Unis, Abiomed, Inc. est un des principaux fournisseurs de dispositifs médicaux offrant une assistance circulatoire. Nos produits sont conçus pour permettre au cœur de se reposer en améliorant la circulation sanguine et/ou en effectuant le pompage du cœur. Pour plus d'informations, veuillez consulter le site www.abiomed.com.
Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist et Impella Connect sont des marques déposées d'Abiomed, Inc., enregistrées aux États-Unis et dans certains pays étrangers. Impella BTR, Impella ECP, CVAD Study et STEMI DTU Study sont des marques de commerce en instance d'Abiomed, Inc.
DÉCLARATIONS PROSPECTIVES
Le présent communiqué contient des déclarations prospectives, notamment des déclarations concernant le développement des produits existants et nouveaux d'Abiomed, les progrès de la société en matière de croissance commerciale, ainsi que les opportunités futures et les approbations réglementaires attendues. Les résultats réels de l'entreprise peuvent différer sensiblement de ceux prévus dans ces déclarations prospectives en raison d'un certain nombre de facteurs, notamment les incertitudes liées à la portée, à l'ampleur et à la durée de l'impact de la pandémie de COVID-19, au développement, aux essais et aux approbations réglementaires connexes, y compris le potentiel de pertes futures, à la complexité de la fabrication et aux exigences de qualité élevées, la dépendance à l'égard de sources d'approvisionnement limitées, la concurrence, l'évolution technologique, la réglementation gouvernementale, les litiges, les besoins futurs en capitaux et l'incertitude du financement supplémentaire, ainsi que d'autres risques et défis détaillés dans les documents déposés par la société auprès de la Commission américaine des valeurs mobilières et boursières (SEC), y compris le dernier rapport annuel sur formulaire 10-K et les documents déposés ou fournis ultérieurement à la SEC. Le lecteur est invité à ne pas se fier indûment aux déclarations prospectives, valables uniquement à la date du présent communiqué de presse. La société ne s'engage aucunement à publier les résultats des révisions de ces déclarations prospectives qui pourraient être apportées pour tenir compte d'événements ou de circonstances postérieurs à la date du présent communiqué de presse ou d'événements imprévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.