DANVERS, Massachusetts--(BUSINESS WIRE)--Abiomed (NASDAQ: ABMD), Hersteller der Herzpumpe Impella, meldet die Übernahme von Breethe, Entwickler eines neuartigen extrakorporalen Membranoxygenierungssystems (ECMO), das das Produktportfolio von Abiomed ergänzen und erweitern soll. Dies wird insbesondere Patienten zugutekommen, deren Lungen das Blut nicht länger mit genügend Sauerstoff anreichern können, wie etwa Patienten, die an kardiogenem Schock oder Lungenversagen leiden, das durch ARDS, H1N1, SARS oder COVID-19 verursacht werden kann. Auch in der Pädiatrie kann ECMO als eine primäre Methode der Oxygenierung und hämodynamischen Unterstützung zum Einsatz kommen.
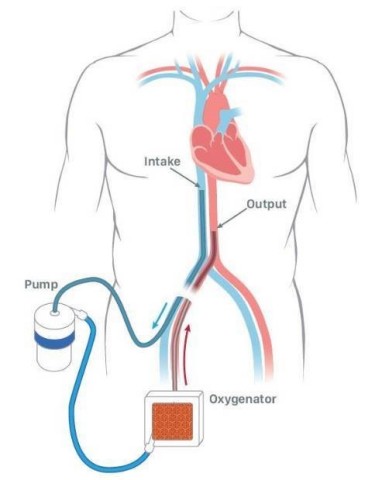
Patienten, die eine ECMO-Therapie benötigen, leiden an schweren und lebensbedrohenden Erkrankungen, die die Lungenfunktion beeinträchtigen. Das System wird über Schläuche (Kanülen) an den Patienten angeschlossen und ist ein äußeres atmungsunterstützendes Gerät, das ganz ähnlich wie die Lunge selbst Kohlendioxid aus dem Venenblut entfernt und dieses mit Sauerstoff anreichert. Das oxygenierte Blut wird dann dem Patienten wieder zugeführt. Jedes Jahr werden in den USA mehr als 20.000 Patienten mit ECMO-Therapie behandelt.
Abiomed erkennt den Bedarf an ECMO-Therapie für Patienten, die Oxygenierung benötigen, und hat in den vergangenen 10 Jahren rund 10.000 an kardiogenem Schock leidende Patienten mit ECMO plus Impella (ECPellaTM) unterstützt. In Japan erhalten mehr als die Hälfte der mit Impella behandelten Patienten eine ECPella-Therapie für hämodynamische und oxygenierende Unterstützung.
Das von Breethe angebotene Produkt ist ein benutzerfreundliches, kompaktes ECMO-System, das erste seiner Art, mit einem integrierten Sauerstoffkonzentrator, der unhandliche Sauerstoffflaschen überflüssig macht, was die Patientenmobilisierung erleichtert. Dank seines neuartigen Designs kann das System vom Gesundheitsdienstleister intuitiv aufgebaut, betreut und überwacht werden. Abiomed hat Mitte 2019 in Breethe investiert. Breethe hat einen Antrag nach 510(k) bei der US-amerikanischen Arzneimittelaufsichtsbehörde FDA gestellt.
Breethe wurde von Dr. med. Bartley Griffith, Hales Distinguished Professor of Surgery an der medizinischen Fakultät der University of Maryland, gegründet. Dr. Griffith hat sich als Arzt auf mehreren Gebieten der Herzchirurgie für Erwachsene, darunter auch mechanische Kreislaufunterstützung, einen Namen gemacht und arbeitet seit einigen Jahren mit Abiomed zusammen. Er war zudem Studienleiter der Studie RECOVER I. Mit jahrzehntelanger Erfahrung entwickelten Dr. Griffith und sein Team das richtungweisende Breethe-System mit einer neuartigen Sauerstoffanreicherung, um die Behandlungsergebnisse zu verbessern, die Lebensqualität der Patienten zu erhöhen und die Gesamtversorgungskosten zu senken.
„Abiomed ist das am besten aufgestellte Unternehmen, um auf die von uns gelegten Grundsteine aufzubauen“, erklärte Dr. Griffith. „Ich bin zuversichtlich, dass die Integration der Technologie von Breethe in das Produktportfolio von Abiomed dessen Fähigkeit steigern wird, die Behandlungsergebnisse zu verbessern und eine neue Patientenpopulation zu betreuen.“
„Diese Übernahme ist ein logischer Schritt auf dem Weg zur Verbesserung der Patientenversorgung“, so Dr. med. Matthew D. Bacchetta, MD, Associate Professor, Department of Thoracic Surgery an der Vanderbilt University. „Die kompakte Kompletttechnologie von Breethe soll die Patientenmobilisierung erleichtern, was wiederum die Ergebnisse verbessern und eine aktive Rehabilitierung von Patienten mit Herz-Lungen-Erkrankungen fördern kann.“
„Breethe wird mit Abiomed und unseren Fertigungs-, Qualitätssicherungs-, Vertriebs-, Technik- und Forschungsabteilungen integriert, einschließlich des erstklassigen Clinical Support Center von Abiomed“, sagte Michael R. Minogue, Chairman, President und Chief Executive Officer von Abiomed. „Diese Übernahme steht im Einklang mit unserem Streben nach einer Führungsstellung in den Bereichen Technologie und Innovation. Bei uns stehen die Patienten an erster Stelle und wir bemühen uns stetig um eine Verbesserung der Behandlungsergebnisse. Ärzte haben Abiomed gebeten, diese Technologie in unser Portfolio aufzunehmen, da wir Patienten unterstützen, Anleitung für empfohlene Methoden geben und kritische Daten für die Forschung erfassen können. Diese ECMO-Technologie versetzt uns in die Lage, Patienten mit kardiogenem Schock, die bereits mit Impella unterstützt werden, zu behandeln, ein Angebot für die Pädiatrie aufzunehmen und eine neue Patientengruppe mit Lungenversagen zu behandeln.“
Mit dieser Übernahme erhält Abiomed eine Gelegenheit, herkömmliche ECMO-Technologie innovativ einzusetzen, mit Fokus auf Patientenmobilisierung und Genesung von akutem Lungenversagen. Für viele Patienten mit kardiogenem Schock ist Impella die optimale Technologie, da sie die linke Herzkammer entlastet, Endorgane durchblutet und dem Herzen Ruhe und Erholung ermöglicht. Abiomed weiß, dass Patienten mit kardiogenem Schock unter Umständen auch Oxygenierung benötigen. ECMO sorgt für die Durchblutung der Endorgane, aber nicht für eine Entlastung der linken Herzkammer. Dadurch erhöht sich der Sauerstoffbedarf des Myokardiums (Herzmuskels) bei diesen Patienten. Bei Patienten mit kardiogenem Schock arbeiten Impella und ECMO (ECPella) zusammen, um das Herz zu entlasten und das Blut mit Sauerstoff zu versorgen.
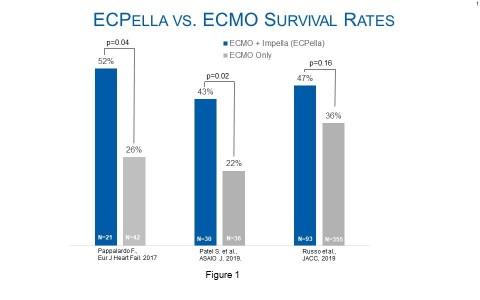
Mehrere Studien belegen den Zusammenhang zwischen ECPella-Therapie und verbesserten Behandlungsergebnissen bei Patienten mit kardiogenem Schock und notwendiger Oxygenierung. Im European Journal of Heart Failure, ASAIO und dem Journal of the American College of Cardiology wurden Studien veröffentlicht, mit denen insgesamt 4.126 Patienten untersucht wurden und die zu dem Schluss gelangten, dass der Einsatz von ECPella mit höheren Überlebensraten in Verbindung stand im Vergleich zu Patienten, die nur mit ECMO behandelt wurden (siehe Abb. 1). Neben höheren Überlebenszahlen wurden in der im European Journal of Heart Failure veröffentlichten Studie auch höhere Herzgenesungsraten mit ECPella ermittelt als beim Einsatz von ECMO allein (62 % vs 36 %; p=0,048).
Die Übernahmebedingungen wurden nicht bekanntgegeben.
ÜBER IMPELLA-HERZPUMPEN
Die Geräte Impella 2.5® und Impella CP® haben die PMA-Zulassung der FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen erhalten, die sich einer elektiven und dringlichen perkutanen Koronarintervention (PCI), wie etwa einer Stentimplantation oder Ballonangioplastie, unterziehen, um verstopfte Koronararterien freizumachen. Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5™ mit Smart Assist® sind von der FDA zugelassene Herzpumpen zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können. Impella RP® ist von der FDA zur Behandlung von Rechtsherzinsuffizienz oder Dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, einem Myokardinfarkt, einer Herztransplantation oder einer Operation am offenen Herzen zugelassen. Impella ist das am intensivsten erforschte mechanische Kreislaufunterstützungssystem in der Geschichte der FDA mit mehr als zehnjährigen FDA-Studien, Daten aus der klinischen Praxis zu über 140.000 Patienten und mehr als 650 Peer-Review-Veröffentlichungen.
In Europa besitzen Impella 2.5, Impella CP und Impella CP mit SmartAssist die CE-Kennzeichnung für eine bis zu fünftägige Behandlung von Hochrisiko-PCI- und AMI-Patienten, die einen kardiogenen Schock erlitten haben. Impella 5.0 und Impella LD haben die CE-Kennzeichnung für eine bis zu zehntägige Behandlung von Patienten mit Herzinfarkt oder Kardiomyopathie mit kardiogenem Schock. Mit der Herzpumpe 5.5™ mit Smart Assist® mit CE-Kennzeichnung werden Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock bis zu 30 Tage lang behandelt. Die Impella RP ist eine mit der CE-Kennzeichnung versehene Herzpumpe zur Behandlung von Patienten mit Rechtsherzversagen oder Dekompensation nach Implantation eines linksventrikulären Unterstützungssystems, Myokardinfarkt, Herztransplantation, Operation am offenen Herzen oder refraktärer ventrikulärer Arrhythmie.
Nähere Informationen über die Impella-Herzpumpenplattform, einschließlich der zugelassenen Indikationen und wichtiger Sicherheits- und Risikoinformationen zur Anwendung der Geräte, finden Sie unter www.impella.com.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers (Massachusetts, USA) ist ein führender Anbieter von Medizintechnikgeräten zur Kreislaufunterstützung. Unsere Produkte sollen durch die Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens die Erholung des Herzens ermöglichen. Weitere Informationen finden Sie unter www.abiomed.com.
Abiomed, Impella, Impella 2.5, Impella 5.0, Impella LD, Impella CP, Impella RP, und Impella Connect sind eingetragene Marken von Abiomed, Inc., und in den USA sowie in bestimmten anderen Ländern eingetragen. Impella BTR, Impella 5.5, Impella ECP, CVAD Study, DTU STEMI Study und SmartAssist sind angemeldete Marken von Abiomed, Inc.
ÜBER BREETHE
Breethe hat für sein OXY-1-System einen Antrag nach 510 (k) bei der FDA gestellt, dem jedoch noch nicht stattgegeben wurde. Die in dieser Mitteilung enthaltenen Angaben über künftige Produkte von Breethe dienen lediglich Informationszwecken für Investoren und verstehen sich nicht als Angaben zu medizinischen Behandlungszwecken. Keine in dieser Mitteilung enthaltene Aussage ist als Zusicherung von Sicherheit oder Wirksamkeit bezüglich künftiger Produkte oder Indikationen zu verstehen.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter Aussagen in Bezug auf die Entwicklung bereits bestehender und neuer Produkte von Abiomed, Fortschritte beim kommerziellen Wachstum des Unternehmens, künftige Möglichkeiten und erwartete behördliche Zulassungen. Die tatsächlichen Ergebnisse des Unternehmens können aufgrund einer Reihe von Faktoren maßgeblich von den in diesen zukunftsgerichteten Aussagen dargestellten Erwartungen abweichen, darunter Unwägbarkeiten in Verbindung mit Umfang, Reichweite und Dauer der Auswirkungen der COVID-19-Pandemie, mit der Entwicklung und Prüfung sowie damit verbundenen behördlichen Zulassungen, einschließlich der Möglichkeit künftiger Verluste, mit komplexer Herstellung, hohen Qualitätsanforderungen, Abhängigkeit von begrenzten Bezugsquellen, Wettbewerb, technologischen Veränderungen, staatlichen Auflagen, Rechtsstreitigkeiten, künftigem Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie anderen Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission hinterlegten Unterlagen des Unternehmens, einschließlich des neuesten Jahresberichts auf Formblatt 10-K und danach eingereichten Unterlagen, näher ausgeführt werden. Leser werden darauf hingewiesen, sich nicht über Gebühr auf solche zukunftsgerichteten Aussagen zu verlassen, da diese nur für den Zeitpunkt dieser Pressemitteilung gelten. Das Unternehmen übernimmt keinerlei Verpflichtung, Aktualisierungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, die Ereignisse oder Umstände widerspiegeln, die nach dem Zeitpunkt der Veröffentlichung eintreten oder durch das Eintreten unvorhergesehener Ereignisse zustande kommen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.