DANVERS, Mass.--(BUSINESS WIRE)--In einer Entwicklung, die einen Meilenstein bei der wissenschaftlichen Forschung bedeutet, hat Abiomed (NASDAQ: ABMD) in den vergangenen fünf Jahren mehr als 100 Millionen US-Dollar in die klinische Forschung zu Impella-Herzpumpen investiert. Abiomeds Engagement bei der klinischen Forschung wird auf einer neuen Website detailliert vorgestellt, die heute live geschaltet wurde.
Die von Abiomed gesponserten Forschungsbemühungen werden durch zwei Jahrzehnte unabhängiger Forschungsinitiativen unter ärztlicher Aufsicht sowie mehr als 550 der Peer-Review unterzogene akademischen Arbeiten ergänzt. Diese Studien konnten den hämodynamischen Nutzen von Impella bestätigen. Impella entlastet den linken Ventrikel direkt und ermöglicht eine Wiederherstellung der Herzfunktion. Daher wurde Impella in acht klinische Richtlinien¹ aufgenommen und von mehreren regulatorischen Stellen zugelassen, darunter das europäische CE-Zeichen, die japanische PDMA-Zulassung und die höchste regulatorische Zulassung durch die FDA in den USA, die PMA-Zulassung.
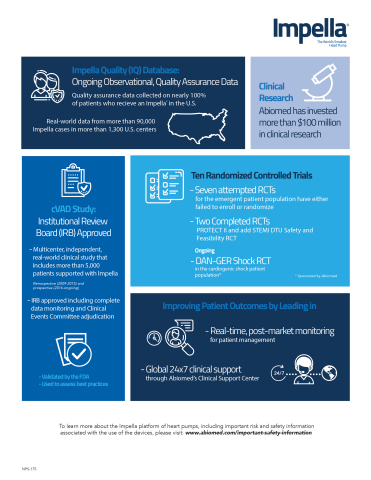
Bis dato hat das Engagement von Abiomed in der klinischen Forschung u. a. Folgendes unterstützt:
-
Eines der umfassendsten und vollständigsten
Anwendungsbeobachtungs-Programme in der Branche für Medizinprodukte,
darunter:
- die Impella Quality Assurance (IQ)-Datenbank, die realistische Anwendungsergebnisdaten von fast 100 % der Impella-Patienten an mehr als 1300 US-Zentren erfasst und mit unabhängigen Forschern zur Analyse teilt. Daten aus der IQ-Datenbank unterstützen die kontinuierliche Verbesserung der Ergebnisse, indem z. B. der Nutzen von Impella vor der Revaskularisation bei kardiogenem Schock aufgezeigt wird, wie detailliert in einem Impella Update beschrieben, das heute Ärzten zur Verfügung gestellt wurde.
- Die von der FDA geprüfte cVAD-Studie, eine prospektive Studie mit Follow-up von einem Jahr. Die cVAD-Studie trug zur Entwicklung der von Ärzten geleiteten National Cardiogenic Shock Initiative bei, die aufzeigt, dass bei Einhaltung von Best Practice-Verfahren einschließlich der Impella-Platzierung vor perkutanen Koronarinterventionen (PCI) die Überlebensrate bei kardiogenem Schock von ca. 50 % auf 77 % verbessert werden kann.
- Echtzeit-Überwachung von Patienten mit Impella-Unterstützung durch branchenführende klinische Unterstützungsleistungen 24x7. Dies umfasst Rufbereitschaft rund um die Uhr, Vor-Ort-Unterstützung und das cloudbasierte Impella Connect-System, mit dem klinisches Personal und Experten von Abiomeds klinischem Unterstützungszentrum Patienten dezentral in Echtzeit überwachen und dadurch die Ergebnisse verbessern können.
- Zehn unternommene oder abgeschlossene, randomisierte, kontrollierte Studien zu Impella (zwei wurden abgeschlossen, sieben unternommen und eine läuft derzeit noch). Dies umfasst Abiomeds Unterstützung der laufenden randomisierten, kontrollierten Dan-Ger Shock-Studie zu kardiogenem Schock, bei der die Impella CP-Anwendung mit zwei anderen Arten der Kreislaufunterstützung verglichen wird.
- Sechs FDA-Studien, wobei derzeit fünf Anwendungsbeobachtungs-Zulassungsstudien laufen. Diese Studien zeigen Best Practices zur Verbesserung der Patientenergebnisse auf und haben Impella aufgrund der reduzierten Länge des Krankenhausaufenthalts, der reduzierten Anzahl von Wiederholungsverfahren und den niedrigeren Gesamtkosten der Patientenversorgung als kosteneffektivste Therapie mit FDA-Zulassung für die native Wiederherstellung der Herzfunktion etabliert.
- Partnerschaften mit führenden akademischen Instituten zur Erforschung neuer Elemente der Herzphysiologie wie z. B. Bereitstellung von Gentherapie-Vektoren für Patienten mit Herzinsuffizienz, Algorithmen zur Erfassung und Prognose der patientenspezifischen Hämodynamik sowie die Frage, wie die Entlastung des Ventrikels vor der Reperfusion das Herz schützende Signale auslösen kann.
Darüber hinaus plant Abiomed, die klinische Forschung weiterhin aktiv zu unterstützen. Dies umfasst zwei randomisierte, kontrollierte Studien im Jahr 2019. Die geplante Mittelbereitstellung schließt Folgendes ein:
- Randomisierte, kontrollierte STEMI-DTU-Zulassungsstudie, bei der die Entlastung des linken Ventrikels mit Impella mit dem aktuellen Pflegestandard verglichen wird.
- Laufende randomisierte, kontrollierte Dan-Ger Shock-Studie zu kardiogenem Schock.
- Laufende Datenerfassung, Überwachung und Analyse für die IQ-Datenbank, cVAD-Studie und fünf FDA-Anwendungsbeobachtungs-Studien.
„Das Commitment zu klinischer Forschung ist fester Bestandteil der Abiomed-Unternehmenskultur, weil wir uns ganz und gar dem Ziel verschreiben, Gesundheitsanbietern und Patienten Produkte höchster Qualität, möglichst kosteneffektive Lösungen und Best Practices zur Ergebnisverbesserung bereitzustellen“, so Seth Bilazarian, MD, Chief Medical Officer von Abiomed. „Unsere Patienten sind die Motivation für all unser Tun. Das Ziel unseres branchenführenden klinischen Forschungsprogramms besteht darin, mehr Patienten dabei zu helfen, ihre eigene Herzfunktion wiederherzustellen und nach Hause zu ihren Familien zurückkehren zu können.“
Impella ist das einzige FDA-zugelassene, sichere und effektive Produkt für Hochrisiko-PCI, kardiogenen Schock und high-risk PCI, cardiogenic shock, and rechtsseitigen Herzunterstützung. Im Gegensatz zu den meisten von der FDA freigegebenen Medizinprodukten wie intraaortale Ballonpumpen und ECMO werden die Indikationen von Impella durch eine randomisierte, kontrollierte Studie unterstützt, Protect II, die die Sicherheit und Wirksamkeit bestätigt.
In den USA, in Deutschland und Japan wurden bereits mehr als 100.000 Patienten mit Impella behandelt, darunter Tim Deits, ein Teenager, der zuhause im kalifornischen Huntington Beach mit einem kardiogenen Schock zusammengebrochen war. Er wurde eiligst ins Krankenhaus gebracht und mit Impella CP sowie Impella RP behandelt, wodurch sein Herz ruhen und sich erholen konnte.
„Ich bin allen sehr dankbar, die bei der Forschung zur Effektivität der Impella-Herzpumpen mitgeholfen haben. Ohne ihre harte Arbeit über viele Jahre hinweg würde mein Sohn Tim wahrscheinlich nicht mehr leben“, so Ted Deits, Tims Vater. „Tim wurde zunächst eine Überlebenschance von nur 10 % gegeben. Zum Glück war die Impella RP-Herzpumpe nur wenige Wochen vor Tims Herzanfall in unserem lokalen Krankenhaus eingetroffen. Wir schätzen uns unglaublich glücklich, dass Impella bereit stand, um mitzuhelfen, Tims Leben zu retten.“
¹ Clinical society guidelines for Impella therapy:
-
Cardiogenic Shock:
- 2015 SCAI/ACC/HFSA/STS Consensus Document on Hemodynamic Support (JACC)
- 2013 International Society for Heart and Lung Transplantation Guidelines for Mechanical Circulatory Support (J Heart Lung Transplant)
- 2013 ACCF/AHA Guideline for the Management of Heart Failure (JACC)
- 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction (Circulation)
- 2012 Use of Mechanical Circulatory Support: American Heart Association (Circulation)
- 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention (JACC)
-
Protected PCI:
- 2014 AHA/ACC Guideline for the Management of Patients With Non–ST-Elevation Acute Coronary Syndromes (Circulation)
- 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention (JACC)
ÜBER DIE IMPELLA-HERZPUMPEN
Die Geräte Impella 2.5 und Impella CP sind von der FDA in bestimmten Fällen zur Behandlung von Patienten mit fortgeschrittener Herzinsuffizienz zugelassen, die sich elektiven und dringenden perkutanen Koronarinterventionen (PCI), z. B. einer Stentimplantation oder Ballonangioplastie, zum Wiederöffnen blockierter Koronararterien unterziehen müssen. Impella 2.5®, Impella CP®, Impella CP® mit SmartAssist, Impella 5.0® und Impella LD® sind von der FDA für die Behandlung von Herzinfarktpatienten oder Patienten mit Kardiomyopathie, die einen kardiogenen Schock erlitten haben, zugelassene Herzpumpen, die auf einzigartige Weise die Wiederherstellung der eigenen Herzfunktion ermöglichen, sodass Patienten das Krankenhaus mit ihrem eigenen Herzen wieder verlassen können. Weitere Informationen über die Plattform der Impella-Herzpumpen und ihre zugelassenen Indikationen sowie wichtige Informationen zur Sicherheit und zu den Risiken in Verbindung mit der Verwendung dieser Geräte finden Sie unter www.protectedpci.com.
Das ABIOMED-Logo, ABIOMED, Impella, Impella 2.5, Impella 5.0, Impella LD, Impella CP, Impella RP, Impella Connect und Recovering hearts. Saving lives. sind eingetragene Marken von ABIOMED, Inc. in den USA und in bestimmten anderen Ländern.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts, ist ein führender Anbieter von Medizingeräten zur Kreislaufunterstützung. Unsere Produkte dienen dazu, das Herz zu entlasten, indem der Blutfluss verbessert bzw. die Pumpfunktion des Herzens übernommen wird. Weitere Informationen erhalten Sie unter www.abiomed.com.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, darunter Aussagen bezüglich der Entwicklung bestehender und neuer Produkte von Abiomed, des Fortschritts des Unternehmens beim kommerziellen Wachstum sowie künftiger Chancen und erwarteter behördlicher Zulassungen. Die tatsächlichen Ergebnisse des Unternehmens können sich erheblich von den in diesen zukunftsgerichteten Aussagen erwarteten Ergebnissen unterscheiden, was auf einer Reihe von Faktoren basiert, darunter Unsicherheiten in Verbindung mit der Entwicklung, Tests und damit verbundene behördlichen Zulassungen, die Möglichkeit künftiger Verluste, komplexe Herstellung, hohe Qualitätsanforderungen, Abhängigkeit von begrenzten Versorgungsquellen, Wettbewerb, technologische Veränderungen, staatliche Auflagen, Rechtsstreitigkeiten, künftiger Kapitalbedarf und Ungewissheit über zusätzliche Finanzierungsmöglichkeiten sowie andere Risiken und Herausforderungen, die in den bei der Securities and Exchange Commission hinterlegten Unterlagen des Unternehmens, darunter dem neuesten Jahresbericht auf Formular 10-K und dem Quartalsbericht auf Formular 10-Q, angegeben sind. Leser werden davor gewarnt, sich über Gebühr auf solche zukunftsgerichteten Aussagen zu verlassen, da diese nur für den Zeitpunkt gelten, zu dem sie getroffen werden. Das Unternehmen übernimmt keine Verpflichtung, die Ergebnisse möglicher Aktualisierungen dieser zukunftsgerichteten Aussagen zu veröffentlichen, um nach dem Datum dieser Pressemitteilung eingetretene Ereignisse oder das Eintreten von unerwarteten Ereignissen widerzuspiegeln.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.