IRVINE, Kalifornien--(BUSINESS WIRE)--Axonics Modulation Technologies, Inc. (NASDAQ: AXNX), ein Medizintechnikunternehmen, das sich auf die Entwicklung und Vermarktung neuartiger, implantierbarer Medizinprodukte zur sakralen Neuromodulation (SNM) spezialisiert hat, die zur Behandlung von Fehlfunktionen des Harn- und Darmtraktes verwendet werden, gab heute erste klinische Ergebnisdaten aus der ARTISAN-SNM-Pivotstudie bekannt, die bei der US-amerikanischen Arzneimittelzulassungsbehörde (Food and Drug Administration, FDA) eingereicht werden, damit diese das Axonics r-SNM®-System1 zulässt.
In der klinischen Studie wurde gezeigt, dass bei Patienten, bei denen das Axonics r-SNM-System implantiert wurde, klinisch bedeutsame und statistisch signifikante Verbesserungen der Symptome einer Harndranginkontinenz (urinary urgency incontinence, UUI) und der Lebensqualität nachgewiesen werden konnten. Abgesehen davon wurden in der Studie alle sekundären Endpunkte erreicht. Es traten keine schwerwiegenden gerätebezogenen unerwünschten Nebenwirkungen auf.
Bei der ARTISAN-SNM Studie handelt es sich um eine prospektive, multizentrische, nicht verblindete klinische Einzelarm- und Pivotstudie mit 129 Patienten, die von der FDA eine Forschungsausnahmegenehmigung (Investigal Device Exemption, IDE) erhielt, um die Sicherheit und Wirksamkeit des Axonics r-SNM-Systems bei Fehlfunktionen des Harntrakts zu beurteilen. Die Studie wurde in 14 Prüfzentren in den USA und 5 Prüfzentren in Westeuropa durchgeführt.
Dr. Karen Noblett, Chief Medical Officer von Axonics, sagte: „Diese erfolgreiche klinische Studie ist ein wichtiger Meilenstein hinsichtlich der Zulassung durch die FDA. Bisher war die SNM-Therapie nur mit einem nicht wiederaufladbaren implantierten Neurostimulator mit einer durchschnittlichen Lebensdauer von vier Jahren möglich, bei dem aufgrund der Entleerung der Neurostimulatorbatterie eine weitere Operation notwendig war, um entsprechend nachzurüsten. Wir sind davon überzeugt, dass es dank des sehr kleinen, mit wiederaufladbaren 5cc-Batterien betriebenen und für Patienten sowie Kostenträger mit geringeren Kosten verbundenen Axonics-Systems, das mindestens 15 Jahre im Körper verbleiben kann, zu einer deutlich häufigeren Anwendung der SNM-Therapie kommen wird.“
Erste Ergebnisse
Bei allen Patienten, bei denen eine Harndranginkontinenz diagnostiziert wurde, und die den Studienkriterien entsprechen, wurden eine Ankerelektrode und der Axonics-Neurostimulator implantiert. Die Wirksamkeitsdaten wurden auf der Grundlage eines 3-tägigen Blasentaschenbuchs, eines validierten Lebensqualitätsfragebogens (ICIQ-OABqol) und eines Zufriedenheitsfragebogens erhoben. Als Patienten, bei denen die Therapie ansprach, wurden Patienten definiert, bei denen die Harndranginkontinenz bei Nachuntersuchungen im Vergleich zum Studienbeginn um mindestens 50 % reduziert wurde. Bei allen 129 Patienten, die sich einer Implantation unterzogen hatten, wurde eine Behandlungsanalyse durchgeführt.
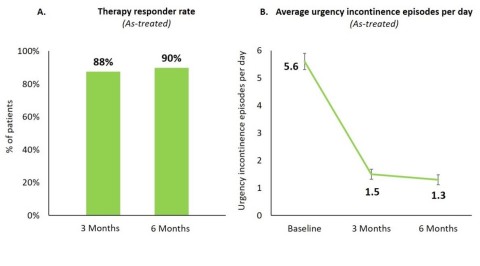
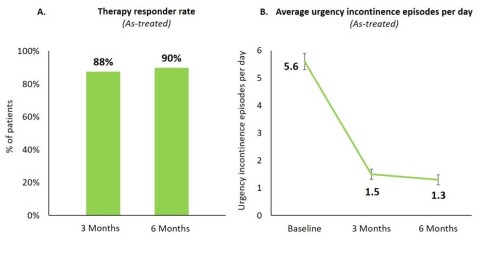
Nach sechs Monaten sprachen 90 % aller Patienten, die sich einer Implantation unterzogen hatten, auf die Therapie an (Abbildung 1 A). Bei 80 % der Patienten, die auf die Therapie ansprachen, wurde eine Verringerung der Harndranginkontinenz um ≥75 % festgestellt, bei 34 % von ihnen lag keine Inkontinenz mehr vor.
Bei allen Patienten reduzierte sich die Häufigkeit der Harndranginkontinenz pro Tag von 5,6 ± 0,3 (mittlerer Fehler ± Standardfehler) zu Studienbeginn auf 1,3 ± 0,2 nach sechs Monaten (p<0,0001; Abbildung 1 B).
Die Patienten erzielten nach sechs Monaten im Durchschnitt statistisch und klinisch gesehen signifikante Verbesserungen gegenüber dem ICIQ-OABqol-Score (34 Punkte) im Vergleich zum Studienbeginn und 93 % aller Patienten, bei denen eine Implantation vorgenommen wurde, waren mit ihrer r-SNM-Therapie zufrieden.
Stand der Genehmigung vor Markteinführung (Premarket Approval, PMA) durch die US-amerikanische Arzneimittelzulassungsbehörde (Food and Drug Administration, FDA)
Axonics hat am 3. Dezember 2018 einen PMA-Antrag und Ende 2018 vorläufige klinische Daten aus der ARTISAN-SNM-Studie bei der FDA eingereicht. Die in diesem Bericht offengelegten klinischen Daten wurden von der FDA noch nicht geprüft. Axonics beabsichtigt, die über einen Zeitraum von 6 Monaten erhobenen klinischen Daten in der Woche vom 18. Februar bei der FDA einzureichen. Axonics geht nicht davon aus, dass sich die Einreichung dieser zusätzlichen klinischen Daten auf den 180-tägigen PMA-Überprüfungszeitraum auswirken wird, in dem die FDA ihre Überprüfung abschließen und eine schriftliche Entscheidung bekannt geben wird.
Telefonkonferenz und Webcast
Wie bereits angekündigt, wird das Unternehmen am Dienstag, den 5. März 2019, um 16:30 Uhr Eastern Time (bzw. 22:30 Uhr MEZ) eine Telefonkonferenz mit der Investment-Community durchführen, um die Finanzergebnisse des vierten Quartals 2018 und des Gesamtjahres sowie die jüngsten Geschäftsentwicklungen, einschließlich klinischer Daten aus der ARTISAN-SNM-Studie zu erörtern.
Interessierte können per Telefon auf die Live-Schaltung zugreifen, indem sie (866) 687-5771 (in den USA) oder (409) 217-8725 (international) anwählen und den Zugangscode 3386378 angeben. Ein Live-Webcast der Konferenz steht über die „Events & Presentations“-Seite im Abschnitt für Anleger auf der Website des Unternehmens unter ir.axonicsmodulation.com zur Verfügung. Eine Wiederholung des Webcast wird kurz nach Abschluss der Telefonkonferenz verfügbar gemacht und auf der Website des Unternehmens 90 Tage lang archiviert.
Über Blasenhyperaktivität und sakrale Neuromodulation
In den USA und Europa sind schätzungsweise 85 Millionen Erwachsene von Blasenhyperaktivität betroffen, die Harndranginkontinenz und häufiges Wasserlassen umfasst. Eine Blasenhyperaktivität wird durch eine fehlerhafte Signalübertragung zwischen Blase und Gehirn verursacht und beeinträchtigt die Lebensqualität signifikant. Die SNM-Therapie ist eine bewährte Behandlungsform, die weiträumig zur Symptomlinderung und Wiederherstellung der Blasenfunktion genutzt wird. Auch wird sie zur Behandlung von Harnverhalt und Stuhlinkontinenz eingesetzt. Die Kostenerstattung für SNM ist in den USA durchaus üblich und erfolgt auch in Europa, Kanada und Australien über die Krankenversicherungen.
Über Axonics Modulation Technologies, Inc.
Axonics mit Sitz in Irvine, CA, konzentriert sich auf die Entwicklung und Vermarktung eines neuartigen implantierbaren SNM-Systems für Patienten mit Harn- und Darmfehlfunktionen. Das Axonics r-SNM-System ist das erste wiederaufladbare sakrale Neuromodulationssystem, das in Europa, Kanada und Australien zum Verkauf zugelassen ist. Das r-SNM-System bietet ein temporäres externes Einweg-Testsystem, einen miniaturisierten und wiederaufladbaren langlebigen Stimulator, der im Körper für eine Funktionsdauer von mindestens 15 Jahren geeignet ist. Ebenfalls enthalten sind eine verzinnte Leitung sowie patientenfreundliches Zubehör wie ein auf minimale Ladezeit ohne Überhitzung optimiertes Ladesystem, eine kleine, einfach zu bedienende Patientenfernbedienung und ein intuitives Klinikprogrammiergerät, das die Platzierung und Programmierung der Leitungen erleichtert. Weitere Informationen finden Sie auf der Unternehmens-Website unter www.axonicsmodulation.com
Zukunftsgerichtete Aussagen
Aussagen in dieser Pressemitteilung, die sich auf zukünftige Pläne, Ereignisse, Prognosen oder Ergebnisse beziehen, sind zukunftsgerichtete Aussagen im Sinne des Private Securities Litigation Reform Act von 1995. Wörter wie „geplant“, „erwartet“, „glaubt“, „geht davon aus“, „konzipiert“ und ähnliche Ausdrücke sollen solche zukunftsgerichteten Aussagen kennzeichnen. Während diese zukunftsgerichteten Aussagen auf den aktuellen Erwartungen und Überzeugungen der Unternehmensleitung basieren, unterliegen sie einer Reihe von Risiken, Ungewissheiten, Annahmen und sonstigen Faktoren, die dazu führen könnten, dass die tatsächlichen Ergebnisse wesentlich von den in dieser Pressemitteilung geäußerten abweichen, einschließlich der Risiken und Ungewissheiten, die in den Berichten von Axonics bei der Securities and Exchange Commission offengelegt wurden und online unter www.sec.gov verfügbar sind. Die Leser werden aufgefordert, kein unangemessenes Vertrauen in diese zukunftsgerichteten Aussagen zu setzen, da diese nur zum aktuellen Zeitpunkt gültig sind. Wenn nicht gesetzlich vorgeschrieben, übernimmt Axonics keine Verpflichtung, zukunftsgerichtete Aussagen infolge neuer Informationen, veränderter Umstände oder unvorhergesehener Ereignisse zu aktualisieren oder zu revidieren.
______________________
1 Das Axonics r-SNM-System wird derzeit als Prüfmedizinprodukt bezeichnet
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.