PARIS--(BUSINESS WIRE)--Regulatory News:
ABIVAX (Paris:ABVX) (Euronext Paris : FR0012333284 – ABVX), société de biotechnologie innovante ciblant le système immunitaire pour développer des traitements contre des maladies virales et inflammatoires ainsi que le cancer, a publié aujourd’hui ses résultats financiers de l’exercice 2017 clos le 31 décembre, et présenté ses avancées ainsi que ses prévisions pour 2018. Les comptes annuels vérifiés de 2017 ont été arrêtés le 15 mars 2018 par le Conseil d’Administration. Le rapport de certification par les commissaires aux comptes est en cours d'émission.
« 2017 a été une année passionnante pour ABIVAX. Nous avons réalisé d’importants progrès dans le développement de notre portefeuille et affiché de très bonnes performances financières », a indiqué le Professeur Hartmut Ehrlich, M.D., Directeur Général d’ABIVAX. « ABX464, le candidat médicament le plus avancé de la Société, a montré dans deux études cliniques différentes qu’il induisait une réduction du réservoir viral du VIH pouvant atteindre 50 % après seulement un mois de traitement. Ces données valident son rôle notoire de pilier pour une guérison fonctionnelle potentielle chez les patients atteints du VIH. Les premiers résultats issus d’un traitement à plus long terme (3 mois) sont attendus pour le milieu de l’année 2018 et nous prévoyons de déposer, également en milieu d’année, les demandes d’autorisations réglementaires aux Etats-Unis et en Europe afin de débuter une étude clinique de phase IIb pour l’utilisation d’ABX464 chez les patients atteints du VIH. Ces données et activités planifiées renforcent l’engagement d’ABIVAX dans l’amélioration de la vie des patients atteints du VIH. »
Le Dr. Ehrlich, poursuit : « Nous faisons également d’excellents progrès dans notre étude clinique de phase IIa de preuve de concept portant sur l’ABX464 administré à des patients atteints de colite ulcéreuse. La moitié des patients a déjà été recrutée et les premières données sont attendues durant le second semestre 2018 à l’occasion de l’initiation de la phase IIb, qui portera sur le traitement des MICI et débutera en fin d’année. »
« Enfin, grâce à une extension de nos ressources financières pour au moins une année supplémentaire, nous serons en mesure de financer toutes les activités prévues jusqu’au milieu de l’année 2019. » ajoute le Dr. Ehrlich.
FAITS MARQUANTS D’EXPLOITATION 2017
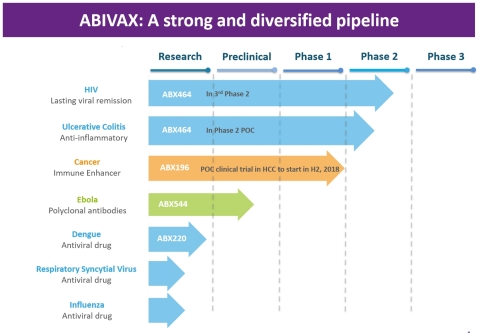
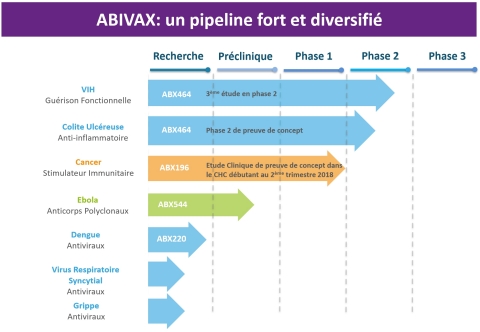
Stratégie de développement : exploiter les technologies propriétaires pour découvrir et développer de nouveaux candidats médicaments ciblant le système immunitaire humain
ABIVAX développe des traitements antiviraux et des immunothérapies issus de ses trois plateformes technologiques propriétaires :
-
« Antivirale », basée sur des technologies
développées en collaboration avec le Centre National de la Recherche
Scientifique (CNRS) de Montpellier et l’Institut Curie d’Orsay. Cette
plateforme a permis d’établir une chimiothèque hautement ciblée de
plus de 1 200 composés conçus pour bloquer la réplication virale grâce
à un mode d’action totalement inédit, comme la modulation de la
biogenèse d'ARNm. La pertinence de cette plateforme a été illustrée
par l’ABX464, une molécule qui a d’ores et déjà été administrée à plus
de 170 sujets et qui s’est avérée être sûre et bien tolérée. Elle a
également démontré une efficacité jusque-là jamais observée en matière
de réduction des réservoirs viraux, ainsi que de la charge virale,
chez les patients.
En plus de l’ABX464, la plateforme « Antivirale » a permis de développer différentes molécules ciblant d’autres virus, notamment le VRS, celui de la grippe ou encore les 4 sérotypes du virus de la dengue. ABIVAX développe ces molécules inédites – actuellement au stade « hit-to-lead » – en collaboration avec EVOTEC, un organisme leader mondial des services à la recherche, dans le but de débuter la phase finale d’identification pour la première molécule, un antiviral ciblant le VRS, d’ici la fin de l’année.
- « Stimulation Immunitaire », fondée sur des droits de brevets exclusifs transférés par le Scripps Research Institute (La Jolla, CA, États-Unis). Elle se concentre sur des agonistes des lymphocytes iNKT, dont il a été prouvé qu’ils stimulent la réponse immunitaire humorale et cellulaire. Ils pourraient également avoir des applications cliniques en oncologie et dans le traitement des maladies infectieuses. Le composé stimulateur immunitaire ABX196 ayant démontré des résultats encourageants au cours de tests précliniques pour différents modèles de cancers, ainsi que lors d’un phase I clinique chez des sujets volontaires, ABIVAX prépare actuellement une étude de Phase I de preuve de concept pour le CHC avec un lancement prévu en fin d’année 2018.
- « Anticorps Polyclonaux », qui pourrait générer des anticorps neutralisants pour la prévention et le traitement des infections au virus Ebola. ABX544 est en cours de développement préclinique et ABIVAX organisera les étapes suivantes en fonction des résultats des études en cours.
Mis à jour du portefeuille produits
- ABX464, un élément clé potentiel pour une guérison fonctionnelle du VIH
Au cours des deux dernières décennies, grâce aux antirétroviraux, les patients infectés avec le VIH ont vu leur pronostic évoluer d’une maladie léthale à une maladie chronique, du moins dans les pays occidentaux. Aujourd’hui, environ 37 millions de personnes vivent avec le VIH. Les ventes globales pharmaceutiques pour le VIH atteignaient 24 Milliards $ en 2017. Aucun antirétroviral n’agit au niveau du réservoir viral et de nouveaux traitements sont donc nécessaires afin d’aboutir à une guérison (fonctionnelle).
Développement clinique de l’ABX464 dans le VIH : suite à deux études de phase I menées sur des sujets sains, une première étude de phase IIa menée sur 66 sujets infectés par le virus du VIH-1 a fourni des preuves initiales de l’activité antivirale de l’ABX464 chez l’humain tout en confirmant sa bonne tolérance.
Une seconde étude de phase IIa (ABX464-004), qui a débuté en juin 2016 en Espagne, en Belgique et en France, vise à étudier les effets de l’ABX464 sur les réservoirs viraux (c’est-à-dire les cellules immunitaires contenant l’ADN viral où le virus se « cache » pendant un traitement antirétroviral) lorsque la molécule est administrée en association avec d’autres antiviraux. Au total, 30 patients ont été inclus dans l'étude. Ils ont reçu, pendant 28 jours, l’ABX464 ou un placebo en association avec du Darunavir boosté, un traitement connu pour le VIH. Les résultats de cette étude ont montré, chez 8 patients évaluables sur 15 ayant reçu l’ABX464, une réduction de 25 % à 50 % du réservoir viral contre aucune réduction chez les patients traités par placebo. Ces résultats ont été présentés lors de la 9ème Conférence IAS «HIV Science » à Paris du 23 au 26 juillet 2017, ainsi que lors de la 16ème Conférence Européenne AIDS (EACS) organisée à Milan, en Italie, du 25 au 27 octobre 2017.
En mars 2017, ABIVAX a initié une étude clinique de pharmacocinétique (PK) compartimentale (ABX464-005). Lors de cette étude, des patients porteurs du VIH ont reçu l’ABX464 pendant 28 jours lors de la cohorte 1 (terminée) et pendant 84 jours dans la cohorte 2 (en cours) en plus de leur traitement antirétroviral habituel. Dans la cohorte 2, des biopsies rectales sont réalisées en plus des prises de sang à différents intervalles pour permettre de quantifier le réservoir viral et le degré d’inflammation du tissu intestinal. Menée au sein de l’hôpital universitaire Germans Trias i Pujol de la commune de Badalona (Barcelone, Espagne), cette étude pourrait permettre d’améliorer la compréhension de la réduction du réservoir dans le sang et dans les intestins, dont on pense qu’ils contiennent le plus grand réservoir du VIH dans le corps.
Les résultats de la première cohorte (28 jours de traitement) ont pleinement confirmé les résultats de l'étude précédente : une réduction pouvant aller jusqu’à 50 % des réservoirs sanguins du VIH a été constatée chez 8 patients sur 9 (p < 0,001). Ces résultats ont été présentés de la 8ème édition de la Conférence Internationale sur la Persistance du VIH pendant les traitements, ayant eu lieu à Miami, en Floride, du 12 au 15 décembre 2017. Les premiers résultats de la seconde cohorte en cours sont attendus d’ici mi-2018.
Les résultats des études ABX464-004 et -005 devraient aider ABIVAX à concevoir l’étude de phase IIb, prévue pour débuter aux alentours de la fin d’année 2018.
- L’ABX464, une molécule avec un fort effet anti-inflammatoire pouvant mener à une indication potentielle dans le traitement des maladies inflammatoires chroniques de l’intestin (colite ulcéreuse)
La colite ulcéreuse est une maladie inflammatoire chronique de l’intestin débilitante chez les adultes et les enfants, avec peu d’options thérapeutiques. Environ 1 million de patients en sont atteints aux Etats-Unis avec des ventes pharmaceutiques d’environ 5,7 Milliards $ en 2017.
Développement clinique de l’ABX464 dans la colite ulcéreuse : En novembre 2017, ABIVAX a débuté une étude de phase IIa de preuve de concept en double aveugle et contrôlée contre placebo, menée sur des patients souffrant de colite ulcéreuse modérée à grave. La justification de cette étude découle de nouvelles données précliniques obtenues avec l’ABX464 démontrant un fort effet anti-inflammatoire du composé. Il a été prouvé que sur les macrophages, cet effet était médié par une multiplication par 50 de l’expression de l’IL-22, une cytokine connue comme étant un puissant suppresseur des processus inflammatoires, ainsi que par une multiplication par 10 de l’expression du miR124, un micro-ARN présentant de puissantes propriétés anti-inflammatoires, dans les cellules mononucléées sanguines périphériques (PBMC).
Outre dans le cas du VIH, l’inflammation était une caractéristique principale commune à plusieurs autres pathologies observées comme par exemple la colite ulcéreuse et la maladie de Crohn. Étudiée sur un modèle murin de MICI, l’ABX464 a montré un effet durable dans la prévention des symptômes typiques de la colite inflammatoire, notamment les changements histologiques1.
Dans l’étude clinique en cours, 30 patients ont été randomisés selon un ratio 2:1 pour recevoir respectivement l’ABX464 ou un placebo. Cette étude repose sur des technologies de pointe telles que des enregistrements numériques des coloscopies avec une lecture centralisée, visant à surveiller les effets potentiels du traitement. Seize des 30 patients ont déjà été recrutés, et l’essai est en cours avec des premiers résultats attendus au deuxième semestre 2018. Enfin, ABIVAX a reçu les premières autorisations permettant de mener une étude de maintenance en ouvert d'une durée d’un an. Le premier patient reçoit déjà l’ABX464 dans le cadre de ce protocole.
• Mécanisme d’action de l’ABX464
Des progrès significatifs ont été effectué en 2017 dans la caractérisation de l’ABX464 ; de nouvelles données expliquant le mode d’action unique sont en cours d’évaluation et de préparation afin d’être présentées à des conférences scientifiques internationales revues par les pairs.
De nouvelles molécules antivirales découvertes susceptibles de traiter le VRS, le virus de la grippe et le virus de la dengue
ABIVAX a poursuivi l’exploration de sa chimiothèque ciblée de petites molécules dans le but de découvrir et de développer des candidats médicaments antiviraux contre le VRS, le virus de la grippe et les 4 sérotypes de la dengue. Ces molécules sont actuellement au stade de « hit-to-lead » du développement, et le composé ciblant le VRS devrait entrer en phase finale d’identification d’ici la fin de l’année.
- L’ABX311 : développement suspendu
Aucune flambée épidémique n’ayant été observée depuis plusieurs années, le développement de la molécule ABX311, visant le traitement du Chikungunya, a été interrompu courant 2017.
_______________
1 K. Chebli et al., : The Anti-HIV
Candidate ABX464 Dampens Intestinal Inflammation by Triggering Il-22
Production in Activated Macrophages. Nature Scientific Reports 2017,
DOI:10.1038/s41598-017-04071-3
- Le stimulateur immunitaire ABX196 en préparation pour une étude de preuve de concept dans le cadre du CHC (cancer hépatocellulaire)
Précédemment, l’ABX196 a démontré, au cours de tests cliniques de phase I, sa capacité à déclencher une réponse immunitaire tout en étant bien toléré chez des volontaires sains. Les résultats précliniques de l’ABX196 ont démontré son potentiel à transformer des tumeurs non répondantes aux inhibiteurs de points de contrôle en tumeurs répondantes dans le modèle murin de mélanome B16. Plus récemment, la molécule a montré des résultats thérapeutiques encourageants dans un modèle murin de CHC : réduction de la croissance des tumeurs, hausse des taux de survie.
ABIVAX prépare actuellement une étude clinique de preuve de concept de phase I/II avec l’ABX196 pour les patients atteints de CHC, avec un lancement prévu aux alentours de la fin d’année 2018.
Gouvernance et développement du Conseil d’Administration et du Comité Scientifique
En mai 2017 puis en janvier 2018, ABIVAX a développé et diversifié son Conseil d’Administration en nommant Mme Corinna zur Bonsen Thomas, avocate allemande ayant présidé le Conseil de surveillance de Baxter AG à Vienne (Autriche) pendant plus de dix ans, et le professeur Carol Brosgart, M.D., Professeur de Médecine américaine dotée d’une longue expérience dans le traitement des patients, le développement pharmaceutique (notamment chez Gilead) et la santé publique (par exemple au sein du Centre américain pour le contrôle et la prévention des maladies) dans le domaine des maladies infectieuses, et notamment celui du VIH et de l’hépatite B et C. Mme zur Bonsen Thomas présidera le Comité d’Audit du Conseil d’Administration.
Par ailleurs, ABIVAX a accueilli dans son Comité Scientifique, en septembre 2017, le Prof. Christian Brechot, M.D., PhD, Professeur en Médecine de renommée mondiale, spécialiste des maladies infectieuses et ancien Président de l’Institut Pasteur de Paris.
Bpifrance octroie à ABIVAX un financement de 8,4 millions d’euros dans le cadre de son Programme d’Investissements d’Avenir (PIA) en vue de renforcer sa plateforme « Antivirale »
En 2017, ABIVAX et Bpifrance ont signé un accord prévoyant un financement de 8,4 millions d’euros dans le cadre de l’appel à projets « Projets de recherche et développement structurants pour la compétitivité » (PSPC) du Programme d’Investissements d’Avenir (PIA) supervisé par le Commissariat Général de l’Investissement et opéré par Bpifrance.
À cet égard, ABIVAX est à la tête d’un consortium regroupant le CNRS et EVOTEC, l’une des principales sociétés internationales de recherche sous contrat. Un budget total de 18,8 millions d’euros pour une période de 5 ans a été approuvé dans le cadre du projet. Les financements octroyés par Bpifrance s’élèvent à 10,3 millions d’euros au total, dont 8,4 millions de prêts et de subventions à destination d’ABIVAX, et 1,9 million d’euros à destination du CNRS. Le premier paiement d’étape de 2,1 millions d’euros a été perçu au début du mois de septembre 2017.
Ce financement sur atteinte d’objectifs permet à ABIVAX d’accélérer son calendrier de développement et d’optimiser davantage sa plateforme « Antivirale ». Ceci, afin d’identifier des molécules contre d’autres virus engendrant des besoins médicaux élevés, comme le virus respiratoire syncytial, le virus de la dengue ou encore le virus de la grippe.
PRINCIPAUX ÉLÉMENTS FINANCIERS POUR l’EXERCICE 2017
| Éléments du compte de résultat | EXERCICE 2017 | EXERCICE 2016 | Variation | |||
| en milliers d’euros | K € | K € | K € | |||
| Total produits d’exploitation | 357 | 151 | 206 | |||
| Total charges d’exploitation | (14 507) | (18 387) | 3 880 | |||
| dont frais de Recherche et Développement | (10 846) | (15 459) | 4 613 | |||
| dont frais administratifs et généraux | (3 661) | (2 928) | (733) | |||
| Résultat d’exploitation | (14 150) | (18 236) | 4 086 | |||
| Résultat financier | 77 | 258 | (181) | |||
| Résultat courant | (14 073) | (17 978) | 3 905 | |||
| Résultat exceptionnel | 159 | 152 | 7 | |||
| Impôt sur les bénéfices | 2 692 | 3 519 | 827 | |||
| Résultat pour l’exercice | (11 223) | (14 308) | 3 085 | |||
En 2017, la perte d’exploitation a atteint - 14,1 millions d’euros, soit une légère diminution par rapport aux - 18,2 millions d’euros enregistrés en 2016.
Ce chiffre témoigne du contrôle rigoureux opéré par la société en matière de dépenses et de ressources, ainsi que de l’arrêt du développement de l’ABX203, fin 2016. L'étude clinique de phase III portant sur l’ABX203 a engendré près de 5 millions d’euros de coûts en 2016 qui n’ont pas été reproduits en 2017.
Au 31 décembre 2017, ABIVAX comptait 24 employés (hors consultants), soit le même nombre qu’en 2016.
En 2017, les dépenses de R&D s’élevaient à 10,8 millions d’euros, investissements majoritairement ciblés sur l’ABX464, le principal composé chimique ABIVAX, pour un montant de 6,2 millions d’euros (soit 57 %). Les coûts résiduels s’élevaient respectivement à 2,6 millions d’euros (25 %) en développement et à 2 millions d’euros (18 %) en recherche.
Le résultat net était de -11,2 millions d’euros en 2017 contre -14,3 millions en 2016.
Outre le contrôle rigoureux des dépenses pour l’année 2017, la société a également bénéficié du remboursement du Crédit d’Impôt Recherche 2016, ainsi que de la première échéance prévue pour 2017 par le programme de financement de Bpifrance. Ces deux montants combinés s’élèvent à près de 6 millions d’euros et ont été perçus au second semestre 2017.
Le flux de décaissement net de trésorerie pour 2017 a atteint 6 millions d’euros, tandis que la trésorerie disponible en fin d’année s’élevait à 17 millions d’euros contre 23 millions d’euros fin 2016.
En septembre 2017, la société a signé un accord avec Kepler Cheuvreux pour la mise en place d’une ligne de financement en fonds propres permettant à l’entreprise de souscrire des actions à hauteur de 10 % du capital d’ABIVAX (dans la limite de 970 000 nouvelles actions). Fin 2017, ce programme avait permis d’émettre 60 000 actions et de renforcer la trésorerie d’ABIVAX à hauteur de 0,6 million d’euros. Sachant que le prix de l’action est actuellement de 9 euros, la société dispose encore à ce jour d’une réserve potentielle de trésorerie de 7,6 millions d’euros au titre de ce programme.
En se basant sur l’évaluation des besoins prévus en matière de R&D, le solde de la trésorerie et le montant résiduel du financement en fonds propre, ABIVAX est financée jusqu’à la fin du premier semestre 2019.
| Éléments du bilan financier | 31/12/2017 | 31/12/2016 | Variation | ||||
| en milliers d’euros | K € | K € | K € | ||||
| Position financière nette | 16 862 | 22 732 | (5 870) | ||||
| dont immobilisations financières | 15 000 | 15 000 | - | ||||
| dont dépôts à terme (échéance > 1 an) | - | 10 000 | (10 000) | ||||
| dont dépôts à terme (échéance < 1 an) | 15 000 | 5 000 | 10 000 | ||||
| dont trésorerie disponible | 2 032 | 7 987 | (5 955) | ||||
| (dont dettes financières) | (170) | (255) | 85 | ||||
| Total de l’actif | 53 815 | 60 597 | (6 782) | ||||
| Total des fonds propres | 48 180 | 56 718 | (8 538) | ||||
| dont capitaux propres | 43 916 | 54 510 | (10 594) | ||||
| dont avancées conditionnées | 4 264 | 2 208 | 2 056 | ||||
| * À l’exception des éléments du contrat de liquidité (liquidités et actions propres) et des dépôts & garanties. | |||||||
Les actifs de la société à la fin de l’année 2017 comportaient des survaleurs, classées en immobilisations incorporelles, résultant des fusions précédentes de Wittycell (qui a apporté la plateforme « Adjuvant » ainsi que le stimulateur immunitaire dont l’ABX196 est issue) et Splicos (qui a apporté la plateforme « Antivirale » et la petite molécule ABX464). Ces survaleurs s’élevaient à 32 millions d’euros à la fin de l’année 2014, date de création de la société. En raison de progrès significatifs dans le programme ABX464 et ABX196, ABIVAX n’a procédé à aucune dépréciation et la valeur de ces actifs est restée identique en 2017.
PERSPECTIVES POUR 2018
En 2018, la société prévoit d’atteindre les objectifs suivants :
Plateforme « Antivirale » :
- Publication des premiers résultats de la 2ème cohorte de l’étude ABX464-005 mi-2018
- Dépôt d’une demande de nouveau médicament expérimental auprès de la Food and Drug Administration américaine pour la molécule ABX464 pour le VIH d’ici la fin du premier semestre 2018
- Inclusion du premier patient dans l’étude de phase IIb pour l’ABX464 dans le traitement du VIH au cours en fin d’année
- Publication des premiers résultats de l’étude de phase IIa de preuve de concept pour la colite ulcéreuse au second semestre 2018
- Début d’une étude clinique de phase IIb portant sur l’ABX464 dans le traitement de la colite ulcéreuse en fin d’année
- Début de la phase finale d’identification pour la molécule ciblant le VRS d’ici la fin du second semestre 2018
Plateforme « Stimulation Immunitaire » :
- Dépôt d’une demande de nouveau médicament expérimental auprès de la Food and Drug Administration américaine pour l’ABX196 d’ici le milieu de l’année 2018
- Début d’une étude clinique de phase I/II de preuve de concept portant sur l’ABX196 dans le traitement du CHC au deuxième semestre 2018
AGENDA FINANCIER – ÉVÉNEMENTS À PRÉVOIR EN 2018 :
- 15 juin : Assemblée Générale des actionnaires
- 19 septembre : Présentation des résultats du premier semestre 2018
- 28 septembre : Publication du rapport financier pour le premier semestre 2018 sur le site ABIVAX (www.abivax.com)
PRÉSENTATION WEBCAST
L’équipe de direction d’ABIVAX animera un webcast le 16 mars 2018 à 15h00 (heure de Paris) afin d’aborder les résultats de l’exercice 2017 et de faire le point sur les activités en cours. Les participants peuvent se connecter à l’aide des codes téléphoniques suivants (Participant, Local) :
|
Localisation |
Téléphone |
||||
| Allemagne, Francfort | +49 (0)69 2222 2018 | ||||
| Autriche, Vienne | +43 (0)1 928 1466 | ||||
| Belgique, Bruxelles | +32 (0)2 400 6926 | ||||
| Espagne, Madrid | +34 91 419 2524 | ||||
| Etats-Unis, Brooklyn | +1 646-828-8193 | ||||
| France, Paris | +33 (0)1 76 77 22 57 | ||||
| Irlande, Dublin | +353 (0)1 2465621 | ||||
| Italie, Milan | +39 02 3600 9838 | ||||
| Pays-Bas, Amsterdam | +31 (0)20 703 8261 | ||||
| Royaume-Uni, Local | +44 (0)330 336 9411 | ||||
| Suède, Stockholm | +46 (0)8 5065 3942 | ||||
| Suisse, Genève | +41 (0)22 567 5750 | ||||
À propos d’ABIVAX (www.abivax.com)
ABIVAX mobilise la « machinerie » immunitaire naturelle du corps pour traiter les patients atteints d'infections virales, de maladies auto-immunes et encore de cancers. Société en phase clinique, ABIVAX utilise ses plateformes antivirales et immunitaires pour optimiser les candidats médicaments pour guérir le VIH, traiter les maladies inflammatoires de l'intestin ou encore le cancer du foie. ABIVAX est cotée sur le compartiment B d'Euronext (ISIN : FR0012333284 - Mnémo : ABVX).
Plus d'informations sur la société sur www.abivax.com. Suivez-vous sur Twitter @ABIVAX_
DISCLAIMER
Ce communiqué de presse contient des déclarations prospectives, des prévisions et des estimations à l’égard de certains programmes de la Société. Bien que la Société considère que ses déclarations prospectives, prévisions et estimations sont fondées sur des hypothèses et des évaluations des risques, incertitudes et autres facteurs connus et inconnus, qui ont été jugées raisonnables, ces déclarations prospectives, prévisions et estimations peuvent être remises en cause par un certain nombre d’aléas et d’incertitudes, de sorte que les résultats effectifs pourraient différer significativement de ceux anticipés dans lesdites déclarations prospectives, prévisions et estimations. Une description de ces risques, aléas et incertitudes figurent dans les documents déposés par la société auprès de l’Autorité des Marchés financiers au titre de ses obligations réglementaires. En outre, les présentes déclarations prospectives, prévisions et estimations ne sont valables qu’à la date du présent communiqué. Les lecteurs sont donc invités à ne pas se fier indûment à ces déclarations prospectives. ABIVAX décline toute obligation d’actualiser ces déclarations prospectives, prévisions ou estimations afin de refléter tout changement dont la société aurait postérieurement connaissance, à l’exception de ce qui est requis par la législation.