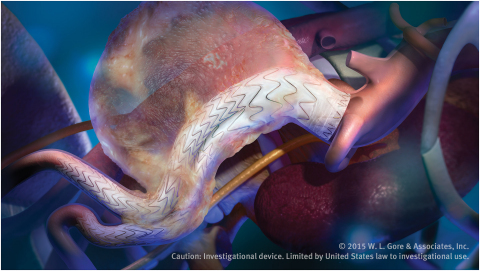
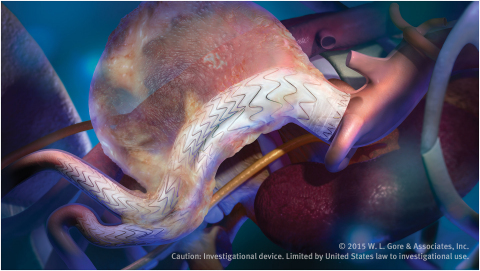
亞利桑那州弗拉格斯塔夫--(BUSINESS WIRE)--(美國商業資訊) -- W. L. Gore & Associates, Inc. (Gore)今天宣佈,GORE® EXCLUDER®適形性AAA器材獲得CE標誌,該產品旨在治療具有挑戰性解剖畸形的腹主動脈瘤(AAA)病患。Gore用於主動脈疾病血管內治療的創新解決方案陣容不斷擴大,該器材是其中的最新成員。該新器材充分利用Gore造福全球超過25萬名病患的AAA器材方面的經驗*,植基於現有套膜血管支架無法比擬的優越記錄。
Gore的創新EVAR解決方案擴展了GORE® EXCLUDER® AAA器材確立的可重新定位能力、耐久性和暢通性傳統。同時,它整合了類似於適形性GORE® TAG®器材的支架設計元素,使其與扭曲主動脈可以契合。該新款適形性AAA器材獲准用於近端主動脈頸角度最大至90度或主動脈頸長度至少10毫米的病患**,對於較困難的解剖畸形,可量身打造治療方式和重要的精確定位。
紐約邁蒙尼德醫療中心(Maimonides Medical Center)血管及血管內外科主任Robert Rhee, MD說:「在此次核准之前,為了符合EVAR的條件,病患不得不配合使用一套相當狹窄的解剖標準子集。GORE EXCLUDER適形性AAA人工血管支架將擴大EVAR對一部分病患的適用性,傳統上認為這些病患的解剖畸形對於血管內治療太具挑戰性。」
該器材引進了Gore的主動式控制系統。該技術允許臨床醫生控制器材的角度,以達到最佳適形性,盡量擴大對近端主動脈頸的封堵。
Gore主動脈業務部負責人Ryan Takeuchi說:「憑藉GORE EXCLUDER適形性器材,本公司的EVAR解決方案將提供市面上所有供應商中最寬廣的治療範圍。該新產品收到的回饋意見顯示,致力於治療挑戰性AAA解剖畸形的醫生對此很有興趣。隨著我們擴大業務規模以滿足這一需求,我們期待將這一有價值的產品帶給病患和醫生。」
GORE EXCLUDER適形性器材是不斷壯大的血管內產品家族的一員,這些產品的共同使命是有效治療主動脈疾病,並以Gore備受讚譽的臨床支援團隊和教育服務為後盾。這一完整的產品陣容包括FDA首次核准的開箱即用型髂支器材——GORE® EXCLUDER®髂 動脈分支支架(IBE),它適用於髂總動脈瘤或主動脈髂動脈瘤的血管內治療。為了備齊分支產品陣容,目前正在美國進行GORE® EXCLUDER®胸腹器材和GORE® TAG®胸支器材研究。
* 根據GORE® EXCLUDER® AAA人工血管支架幹-同側腳的銷量。
**
用於近端主動脈頸角度最大至90度且主動脈頸長度至少15毫米的病患,以及近端主動脈頸角度最大至60度且主動脈頸長度至少10毫米的病患。
關於W. L. GORE & ASSOCIATES
Gore公司為複雜的醫學問題提供有創見的治療解決方案已有40年。在此期間,Gore創新醫療器材的植入數達4000萬枚,挽救並改善了世界各地病患的生命和生活品質。本公司龐大的產品家族包括人工血管、血管內和介入性器材、用於疝氣和軟組織修復的外科網片、釘合線加固材料、以及用於血管外科、心臟外科和一般外科的縫線。本公司名列美國「百大最佳雇主」,是該排名1984年設立以來極少數從未落榜的公司之一。
所列產品可能並非在所有市場有售。GORE®、EXCLUDER®、TAG®及設計是W. L. Gore & Associates的商標。
免責聲明:本公告之原文版本乃官方授權版本。譯文僅供方便瞭解之用,煩請參照原文,原文版本乃唯一具法律效力之版本。