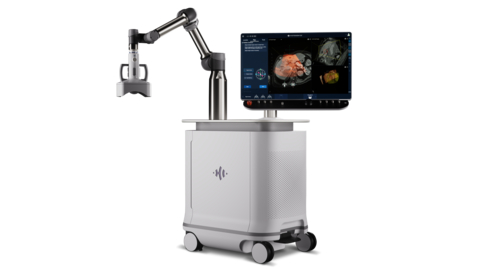
MINNEAPOLIS--(BUSINESS WIRE)--HistoSonics®, (www.histosonics.com), il produttore dell'Edison® System e delle piattaforme innovative di istotripsia terapeutica, ha annunciato oggi di aver ottenuto l'autorizzazione all'immissione sul mercato della sua piattaforma “rivoluzionaria” tramite il procedimento di richiesta di classificazione de novo della U.S. Food and Drug Administration's (FDA), una rigorosa prassi di revisione precedente all'immissione sul mercato di dispositivi medici privi di predicato. L'autorizzazione all'immissione in commercio rende Edison la prima e unica piattaforma di istotripsia disponibile negli Stati Uniti.
L'autorizzazione dell'FDA si è basata, in parte, sui dati forniti dai trial #HOPE4LIVER condotto in 13 centri di sperimentazione negli Stati Uniti e in Europa.
Il testo originale del presente annuncio, redatto nella lingua di partenza, è la versione ufficiale che fa fede. Le traduzioni sono offerte unicamente per comodità del lettore e devono rinviare al testo in lingua originale, che è l'unico giuridicamente valido.