NEW YORK--(BUSINESS WIRE)--IVERIC bio, Inc. (Nasdaq: ISEE) gab heute eine Post-Hoc-Analyse bekannt, in der verschiedene Wachstumsparameter für die geographische Atrophie bewertet wurden. Dabei soll das Voranschreiten der Erkrankung in unterschiedlichen Bereichen der Fovea in einer Untergruppe von Patienten der klinischen Phase-III-Studie GATHER1 zu Zimura® (Avacincaptad Pegol) für die Behandlung von GA untersucht werden.
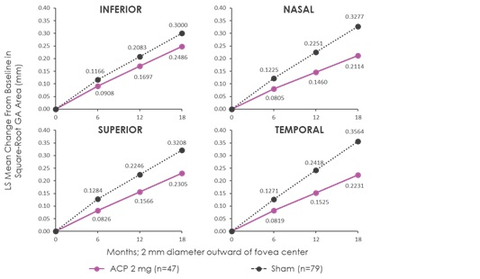
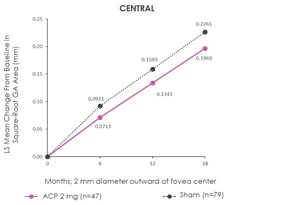
„Im Einklang mit den Gesamtergebnissen von GATHER1 wurde in der neuen Untersuchung bei Patienten, denen 2 mg Zimura verabreicht wurde, im Vergleich zu Patienten, die eine Scheinbehandlung über einen Zeitraum von 18 Monaten erhielten, eine Verringerung des Läsionswachstums in fünf standardmäßigen Bereichen beobachtet, welche den zentralen fovealen Bereich umgeben und einschließen“, erklärte Dhaval Desai, PharmD, Chief Development Officer von Iveric Bio. „Wir denken, dass das beobachtete Muster des reduzierten GA-Wachstums mit dem natürlichen Verlauf der Erkrankung und den jüngsten Ergebnissen aus der klinischen Studie übereinstimmt. Bei dieser wurde eine Komplementhemmung beobachtet, die auf eine größere Verringerung des GA-Wachstums bei Patienten mit nicht-fovealer GA zurückzuführen ist, die von Natur aus schneller voranschreitet als GA, die die Fovea betrifft. Diese Analyse unterstützt unsere Erwartung, dass wir weiter weg von der Fovea centralis ein schnelleres Voranschreiten sehen würden, was das Muster eines für GA-Patienten typischen, umlaufenden Wachstums widerspiegelt.“
„Die geographische Atrophie hat eine große Auswirkung auf das funktionale Sehen, was die Lebensqualität und die Eigenständigkeit der Betroffenen beeinträchtigen kann“, sagte Pravin U. Dugel, MD, President von Iveric Bio. „Wir sind davon überzeugt, dass die Ergebnisse dieser explorativen Analyse einen weiteren Schritt in der Untersuchung des Potentials von Zimura darstellen, um die zentrale Sehschärfe zu erhalten, indem das Fortschreiten von GA verlangsamt wird.“
Die Ergebnisse der Untersuchung der Untergruppe decken sich mit denen der Primärstudie in der Intent-to-treat-Population. In der Post-hoc-Analyse wurde das GA-Wachstum in den fünf standardmäßigen Bereichen der Netzhaut bei Patienten bewertet, für die Bilder zu den relevanten Zeitpunkten vorlagen (n = 47 in der Gruppe mit 2 mg Zimura in und n = 79 in der Scheingruppe). Die fünf Bereiche umfassten den zentralen fovealen Bereich, der aus einem Kreis von 2 mm Durchmesser um den fovealen Mittelpunkt besteht, und vier Quadranten - temporal, nasal, oben und unten - in einem konzentrischen Kreis von 8 mm Durchmesser um den fovealen Mittelpunkt. Die beigefügten Darstellungen veranschaulichen die fünf standardmäßigen Bereiche.
Die beigefügten Graphen zeigen die Ergebnisse der Analyse, die heute beim Angiogenesis, Exudation, and Degeneration Meeting 2022 von Glenn J. Jaffe, MD, Director, Duke Reading Center Chief, Retina Division, Duke Eye Center, Robert Machemer Professor of Ophthalmology, vorgestellt werden.
Iveric Bio wird alle Slides der Präsentation zu Beginn um 11.00 Uhr ET auf der Website des Unternehmens unter https://investors.ivericbio.com/events-and-presentation zur Verfügung stellen.
Über GATHER1 und GATHER2
Wie bereits in einer früheren Pressemitteilung bekannt gegeben wurde, hat GATHER1 gezeigt, dass Zimura (Avacincaptad Pegol) seinen zuvor festgelegten primären Wirksamkeitsendpunkt statistisch signifikant in der klinischen Phase-III-Studie erreicht hat. Die häufigsten unerwünschten Nebenwirkungen am Auge wurden in dieser Studie im Zusammenhang mit dem Injektionsverfahren gemeldet. Das Unternehmen erwartet, dass die ersten Daten für GATHER2, eine klinische Phase-III-Studie zu Zimura für GA, in der zweiten Hälfte von 2022 vorliegen werden, etwa ein Jahr nach der Rekrutierung des letzten Patienten der Studie und der notwendigen Frist für die Datenbanksperre und Analyse. Wenn die Resultate der 12 Monate aus GATHER2 positiv ausfallen, plant das Unternehmen, mit den Ergebnissen aus GATHER1 und GATHER2 bei der U.S. Food and Drug Administration sowie der Europäischen Arzneimittelagentur einen Antrag auf Marktzulassung für Zimura für GA zu stellen. Bislang bestehen für Patienten mit GA keine von der U.S. Food and Drug Administration oder der Europäischen Arzneimittelagentur zugelassenen Behandlungen.
Über Zimura
Zimura (Avacincaptad Pegol) ist ein Prüfpräparat und wurde noch nicht für den globalen Einsatz zugelassen. Zimura zielt auf die Spaltung des Komplementproteins C5 und die Bildung seiner Komponenten, C5a und C5b, sowie deren Hemmung ab. Durch die Hemmung der Bildung dieser Komponenten wird davon ausgegangen, dass Zimura die chronische Entzündung und den Zelltod, die mit dem Prozess der Netzhautalterung zusammenhängen, zu verringern und zu verlangsamen, da die Bildung des Membranangriffskomplexes (MAC) sowie die Inflammasom-Aktivität verringert werden. Dadurch wird die Degeneration von retinalen Pigmentepithelzellen potentiell verhindert oder verlangsamt. Dieser mögliche Mechanismus ist der Grundgedanke für die potentielle Therapie der geographischen Atrophie mit Zimura.
Über Iveric Bio
Iveric Bio ist ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung und Entwicklung neuartiger Behandlungen für Netzhauterkrankungen mit dringendem medizinischen Bedarf konzentriert. Das Unternehmen setzt sich dafür ein, einen positiven Einfluss auf das Leben von Patienten zu nehmen, indem es hochwertige, sichere und wirksame Behandlungen anbietet, die darauf ausgelegt sind, beeinträchtigende Netzhauterkrankungen, darunter frühe Stadien der altersbedingten Makuladegeneration, anzugehen. Weitere Informationen zum Unternehmen finden Sie unter www.ivericbio.com.
Zukunftsgerichtete Aussagen
Alle in dieser Pressemitteilung enthaltenen oder in der Präsentaton getroffenen Aussagen zu den zukünftigen Erwartungen, Plänen und Perspektiven von IVERIC bio sind zukunftsgerichtete Aussagen im Sinne der Safe-Harbor-Bestimmungen gemäß dem Private Securities Litigation Reform Act von 1995. Zukunftsgerichtete Aussagen umfassen alle Aussagen über die Strategie, zukünftigen Tätigkeiten und zukünftigen Erwartungen sowie Pläne und Perspektiven des Unternehmens für das Unternehmen sowie alle anderen Aussagen, welche die Begriffe „antizipieren“, „denken“, „schätzen“, „erwarten“, „vorhaben“, „Ziel“, „können“, „könnten“, „planen“, „vorhersagen“, „projizieren“, „suchen“, „Absicht“, „Potential“, „werden“, „würden“, „könnten“, „sollten“, „weiterhin“ und ähnliche Ausdrücke enthalten. In dieser Pressemitteilung umfassen zukunftsgerichtete Aussagen des Unternehmen Aussagen über seine Erwartungen hinsichtlich der Entwicklungs- und Zulassungsstrategie für Zimura, seine Pläne für zusätzliche Indikationen, wie etwa intermediäre AMD, die das Unternehmen im Rahmen der Entwicklung von Zimura verfolgt, den potentiellen Nutzen von Zimura und die klinische Bedeutung von klinischen Studienergebnissen. Diese zukunftsgerichteten Aussagen enthalten wesentliche Risiken und Unwägbarkeiten, die dazu führen können, dass die Entwicklungsprogramme, zukünftigen Ergebnisse, die Performance oder die Errungenschaften des Unternehmens wesentlich von den durch die zukunftsgerichteten Aussagen ausgedrückten oder implizierten abweichen. Derartige Risiken und Unwägbarkeiten umfassen unter anderem diejenigen in Bezug auf den Fortschritt und den Erfolg der Forschungs- und Entwicklungsprogramme und klinischen Studien, sowie andere Faktoren, die im Abschnitt „Risk Factors“ im Quartals- und Jahresbericht aufgeführt sind, die das Unternehmen bei der Securities and Exchange Commission einreicht. Alle zukunftsgerichteten Aussagen stellen nur die Erwartungen des Unternehmens zum Zeitpunkt dieser Pressemitteilung dar. Das Unternehmen sieht voraus, dass nachfolgende Ereignisse und Entwicklungen dazu führen können, dass sich seine Erwartungen ändern. Das Unternehmen behält sich das Recht vor, diese zukunftsgerichteten Aussagen zu einem bestimmten Zeitpunkt in der Zukunft zu aktualisieren, lehnt jedoch ausdrücklich jegliche Verpflichtung dazu ab, es sei denn, es ist gesetzlich vorgeschrieben.
ISEE-G
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.